Chapitre 1 : les cellules souches
C’est quoi une cellule souche ?
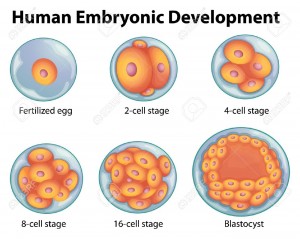
Toutes les cellules dans le corps humain proviennent d’un œuf fécondé qui est formé par l’union de l’ovule et du spermatozoide. Mais le corps est constitué de plus de centaines de différents types de cellules. Tous ces types de cellules proviennent d’un pool de cellules souches dans l’embryon précoce. Au début du développement ainsi que tard dans la vie divers types de cellules souches donnent naissance à des cellules spécialisées ou différenciées qui réalisent les fonctions spécifiques de l’organisme telles que des cellules sanguines, musculaires, osseuses et nerveuses.
Les cellules souches peuvent produire d’autres cellules souches ou régénérer tous types de cellules spécialisées. Cette propriété de la cellule souche la rend attrayante pour les scientifiques qui cherchent à créer des traitements médicaux qui remplacent les cellules perdues ou endommagées.
Différents types de cellules souches :
Les cellules souches se trouvent en chacun de nous dès les premiers stades du développement humain jusqu’à la fin de la vie. Toutes les cellules souches peuvent se révéler utiles pour la recherche médicale mais chacun des différents types possède à la fois la promesse et les limites. Les cellules souches embryonnaires, qui peuvent être dérivées à partir d’un stade très précoce dans le développement humain, ont le potentiel de produire tous les types de cellules du corps. Les cellules souches adultes, qui se trouvent dans certains tissus chez les humains pleinement développés, des bébés aux adultes, peuvent être limitées à la production de certains types de cellules spécialisées. Récemment les scientifiques ont également identifié des cellules souches de sang de cordon ombilical et du placenta qui peuvent donner lieu à divers types de cellules sanguines.
Cellules souches embryonnaires :
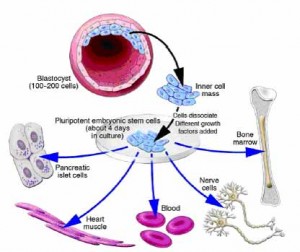
Un blastocyste est un embryon de pré-implantation qui se développe 5 jours après la fécondation d’un ovule par un spermatozoïde. Il contient tout le matériel nécessaire pour le développement d’un être humain complet. Le blastocyste est une sphère presque totalement creuse. A l’intérieur du blastocyste se trouve la masse cellulaire interne qui est composée de 30-34 cellules qui sont désignées par les scientifiques comme pluripotentes car elles peuvent se différencier en tous types de cellules du corps.
Durant le développement normal le blastocyste est implanté dans la paroi de l’utérus pour devenir l’embryon et continuer à se développer jusqu’à un organisme mature. Les cellules externes forment le placenta et la masse cellulaire interne se différencie en différents types de cellules spécialisées du corps.
Lorsque le blastocyste est utilisé pour la recherche sur les cellules souches les scientifiques prennent la masse cellulaire interne et les placent dans un milieu de culture riche en nutriments où elles donnent naissance à des cellules souches embryonnaires. Les cellules souches embryonnaires semblent être plus flexibles que les cellules souches trouvées chez l’adulte parce qu’elles ont le potentiel de produire tous les types de cellules dans le corps humain. Elles sont aussi généralement plus faciles à recueillir, purifier et maintenir dans le laboratoire que les cellules souches adultes. Les scientifiques peuvent induire les cellules souches embryonnaires à se répliquer dans un état indifférencié pendant de très longues périodes de temps avant de les stimuler pour créer des cellules spécialisées. Cela signifie que seulement quelques cellules souches embryonnaires peuvent construire une grande banque de cellules souches pour être utilisée dans des expériences. Cependant ces cellules souches indifférenciées ne peuvent pas être utilisées directement pour les greffes de tissus car elles peuvent provoquer un type de tumeur appelée tératome. Pour être utilisée en clinique les cellules souches embryonnaires devront d’abord être différenciées en cellules spécialisées.
Certains croient que la recherche sur les cellules souches embryonnaires est moralement répréhensible parce que quand les scientifiques suppriment la masse cellulaire interne, le blastocyste n’a plus le potentiel pour devenir un être humain pleinement développé.
Sources de cellules souches embryonnaires (Fécondation In Vitro) :
La plus grande source potentielle de blastocystes pour la recherche sur les cellules souches est la fécondation in vitro (FIV). La FIV nécessite l’extraction des ovules d’une femme par une intervention chirurgicale. Et cela après que la femme a subi un traitement intensif par les « médicaments de fertilité» qui stimulent ses ovaires à produire plusieurs ovules matures. Lorsque la FIV est utilisée à des fins de reproduction les médecins fécondent généralement tous les ovules recueillis afin de maximiser leur chance de produire un blastocyste viable qui peut être implanté dans l’utérus. Comme tous les œufs fécondés ne sont pas implantés il en résulte une grande banque de blastocystes excédentaires stockés dans des congélateurs à travers le pays. Les blastocystes stockés dans des cliniques de FIV pourraient se révéler être une source importante de cellules souches embryonnaires pour une utilisation dans la recherche médicale. Cependant, parce que la plupart de ces blastocystes ont été créés avant l’avènement de la recherche sur les cellules souches, la plupart des donateurs n’ont pas donné leur permission pour utiliser ces blastocystes pour la recherche.
La fécondation in vitro (FIV) pourrait également être utilisée pour produire des blastocystes spécifiquement à des fins de recherche. Cela faciliterait l’isolement des cellules souches avec des traits génétiques spécifiques nécessaires pour l’étude de maladies particulières. Par exemple il peut être possible d’étudier les origines d’une maladie héréditaire comme la fibrose kystique à l’aide de cellules souches fabriquées à partir de donneurs d’ovules et de spermes qui ont cette maladie. La création de cellules souches spécifiquement pour la recherche en utilisant la FIV est, cependant, éthiquement problématique pour certaines personnes car il consiste à créer intentionnellement un blastocyste qui ne pourra jamais se développer en un être humain.
Transfert nucléaire :
Le processus appelé transfert nucléaire offre un autre moyen potentiel de produire des cellules souches embryonnaires. Chez l’animal le transfert nucléaire a été réalisé par l’insertion du noyau d’une cellule différentiée adulte, par exemple une cellule cutanée dans une cellule-oeuf dont le noyau a été enlevé. Cet oeuf, qui contient maintenant le matériel génétique de la cellule de la peau, est stimulé pour former un blastocyste à partir duquel les cellules souches embryonnaires peuvent être obtenues.
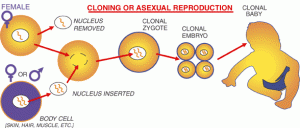
Les cellules qui sont créées de cette manière sont, par conséquent, des copies ou des « clones » de la cellule d’origine de l’adulte car leur ADN nucléaire correspond à celui de la cellule adulte.
Depuis l’été 2006 le transfert nucléaire n’a pas été couronné de succès dans la production de cellules souches embryonnaires humaines mais les progrès dans la recherche suggèrent que les scientifiques pourraient être en mesure d’utiliser cette technique pour développer des cellules souches humaines à l’avenir.
Produire les cellules souches embryonnaires, par transfert de noyaux, n’est pas le même que le clonage reproductif.
L’utilisation du transfert nucléaire pour développer des cellules souches spécifiques de la maladie peut être appelé clonage de recherche et l’utilisation de cette technique pour les greffes de tissus personnalisées est parfois appelée clonage thérapeutique. Ces termes doivent être soigneusement distingués du clonage reproductif dont l’intention est d’implanter un embryon cloné dans l’utérus d’une femelle et de lui permettre de se développer pleinement dans un individu. Ce fut la technique par laquelle le brebis Dolly a été fait et est maintenant largement utilisé pour le clonage reproductif chez les animaux. Chez l’homme, cependant, le clonage reproductif a été activement découragé par la plupart dans la communauté scientifique.
Les scientifiques croient que, s’ils arrivent à utiliser le transfert nucléaire pour obtenir des cellules souches humaines, ils pourraient étudier le développement et la progression de maladies spécifiques en créant des cellules souches contenant les gènes responsables de ces maladies. Dans l’avenir les scientifiques peuvent aussi être en mesure de créer des cellules souches «personnalisées» qui ne contiennent que de l’ADN d’un patient spécifique. Les cellules souches embryonnaires créées par transfert nucléaire seraient génétiquement appariées à une personne qui a besoin d’une greffe ce qui rend beaucoup moins probable que le corps du patient rejète les nouvelles cellules par rapport à ce qu’elles seraient avec les procédures traditionnelles de greffe de tissu.
Bien que l’utilisation du transfert nucléaire pour produire des cellules souches n’est pas le même que le clonage reproductif, certains sont préoccupés par d’éventuelles mauvaises applications de la technique à des fins de clonage reproductif. D’autres considérations éthiques comprennent le don d’ovules, ce qui exige le consentement éclairé et la destruction possible de blastocystes.
Cellules souches adultes :
Les cellules souches adultes sont cachées au plus profond au sein des organes, entourées par des millions de cellules ordinaires, et peuvent aider à reconstituer certaines des cellules de l’organisme en cas de besoin. En fait certaines cellules souches adultes sont actuellement utilisées dans les thérapies. Elles ont été trouvées dans plusieurs organes qui ont besoin d’un apport constant de cellules, tels que le sang, la peau et la doublure de l’intestin, et ont également été trouvées dans des endroits surprenants comme le cerveau qui est connu pour ne pas reconstituer facilement ses cellules. Contrairement aux cellules souches embryonnaires les cellules souches adultes sont déjà quelque peu spécialisées. Par exemple les cellules souches du sang normalement donnent naissance à de nombreux types de cellules sanguines et les cellules souches nerveuses ne peuvent faire que différents types de cellules du cerveau. Toutefois des recherches récentes suggèrent que certaines cellules souches adultes pourraient être plus souples qu’on ne le pensait et peuvent être faites pour produire une plus grande variété de types de cellules. Par exemple certaines expériences ont suggéré que les cellules souches du sang adulte isolées de souris peuvent également être en mesure de produire des cellules hépatiques, musculaires et cutanées mais ces résultats ne sont pas encore éprouvés et n’ont pas été démontrés avec les cellules humaines. Néanmoins les scientifiques travaillent sur la recherche d’un moyen de stimuler les cellules souches adultes ou même d’autres types de cellules adultes à être plus polyvalents. S’ils réussissent ils pourraient fournir une autre source de cellules souches non spécialisées.
Identifier les cellules souches :
Dès 1961 les scientifiques savaient que la moelle osseuse adulte contenait des cellules qui pourraient faire tous les types de cellules sanguines. Mais ce ne fut qu’en 1988 que ces cellules souches ont été isolées comme des populations pures. Pourquoi at-il fallu si longtemps ? Les techniques d’identification des cellules souches ont récemment été mises au point. Ceci est en partie parce que les cellules souches adultes sont, par leur nature même, peu visible dans la forme, la taille et la fonction. Elles ont aussi tendance à se cacher profondément dans les tissus et sont présentes seulement en un très petit nombre ce qui rend leur identification et l’isolement très difficile c’est comme trouver une aiguille dans une botte de foin.
Comment les scientifiques savent quand ils ont trouvé une cellule souche ? Chaque cellule affiche une matrice de protéines sur sa surface; différents types de cellules ont des protéines différentes. Les scientifiques peuvent utiliser ces protéines de surface comme des «marqueurs» qui caractérisent les types de cellules individuelles -un type de ID moléculaire. Par exemple, en utilisant des molécules qui reconnaissent et s’attachent à des protéines de surface spécifiques et qui sont rendues fluorescentes sous certaines longueurs d’onde de la lumière, les scientifiques peuvent visuellement faire la différence entre une cellule de sang. Malheureusement, les cellules souches ne peuvent pas encore être identifiées de cette manière parce que on n’a pas encore identifié des marqueurs pour tous les types de cellules souches. Des scientifiques identifient également les cellules souches en observant leur comportement dans le laboratoire : les cellules souches doivent être en mesure de rester non spécialisées et puissent s’auto-renouveler pour de longues périodes de temps.
Les scientifiques pensent qu’il pourraient y avoir plusieurs types de cellules souches adultes mais les trouver est un processus difficile.
La culture de lignées cellulaires et la stimulation des cellules souches à se différencier :
La culture cellulaire est un terme qui se réfère à la croissance et le maintien des cellules dans un environnement contrôlé à côté d’un organisme. Une culture de cellules souches réussie est celle qui maintient les cellules en bonne santé, dans un état non spécialisé et en division continue. La mise en culture des cellules souches dans la première étape de l’établissement d’une lignée de cellules souches -une collection de multiplication de cellules génétiquement identiques. Les lignées cellulaires sont importantes parce qu’elles fournissent un approvisionnement à long terme de cellules se multipliant qui peuvent être partagées entre les scientifiques pour la recherche et la thérapie. on a décrit certaines difficultés pour le maintien de lignées cellulaires : « au fil du temps, toutes les lignées cellulaires … changement, généralement accumulent des mutations génétiques nuisibles. Il n’y a pas de raison que les lignées de cellules souches se comportent différemment. Alors il faut étudier les raisons, en utilisant les lignées existantes de cellules souches … ces préoccupations nécessitant une surveillance de ces cellules ont continué ainsi que le développement de nouvelles lignées de cellules souches à l’avenir « .
Une fois qu’ils ont mis en place une lignée de cellules souches stables les scientifiques commencent le processus de provoquer les cellules souches à se différencier en types de cellules spécialisées. L’environnement cellulaire dans lequel les cellules souches naturellement résident fournit aux scientifiques des indices sur la façon de les faire différencier dans une boîte de culture. Par exemple dans la moelle osseuse, où les cellules souches du sang résident, les cellules osseuses envoient des signaux physiques et chimiques qui indiquent aux cellules souches du sang de se différencier. Les scientifiques commencent tout juste à comprendre ces signaux et à avoir les moyens développés pour imiter les processus naturels dans les cultures cellulaires. Habituellement la technologie consiste à ajouter certaines protéines de la culture cellulaire et, dans certains cas, l’introduction de gènes spécifiques dans des cellules souches.
Il est essentiel que les scientifiques soient sûrs que les cellules souches sont pleinement différenciées avant de pouvoir les utiliser pour des applications médicales. Si les cellules souches non différenciées complètement (telles que des cellules souches embryonnaires) sont implantées directement dans un organisme, elles peuvent causer un type de tumeur appelé tératome qui a été observé dans des expériences utilisant des souris. Les cellules souches adultes semi-spécialisées et des cellules différenciées dérivées de cellules souches embryonnaires ne sont pas susceptibles de provoquer des tératomes.
Alternatives à l’utilisation d’embryons dans la recherche sur les cellules souches :
Pour répondre aux préoccupations éthiques au sujet de la destruction de blastocystes, les scientifiques tentent de trouver de nouvelles façons d’obtenir des cellules souches qui se comportent comme des cellules souches embryonnaires mais qui ne nécessitent pas la destruction de blastocyste. Comme la science progresse les questions d’éthique entourant ces alternatives peuvent également survenir. Certaines solutions de rechange possibles incluent :
1) Les cellules recueillies à partir de la morula, le stade de développement avant le blastocyste. La morula, une boule solide d’environ 16-30 cellules, semble en mesure de maintenir la perte de quelques cellules sans dommage au développement de sorte que les cellules restantes peuvent continuer à se développer. L’extraction de cellules de la morula est déjà utilisé dans certaines cliniques pour le dépistage de troubles génétiques chez les embryons produits par fécondation in vitro. Des chercheurs ont récemment montré que des cellules isolées à partir d’une morula de la souris peuvent donner naissance à des cellules souches embryonnaires, tandis que les cellules restantes dans la morula se développent en une souris saine. Toutefois ce processus peut encore être moralement inacceptable pour certains en raison de la possibilité d’effets néfastes pour la morula et parce que les effets à long terme, de prélever des cellules de morula, ne sont pas encore connus.
2) La création de cellules souches embryonnaires à travers un processus appelé transfert nucléaire altéré (ANT). Dans cette variante de la technique de transfert nucléaire les scientifiques créent un blastocyste dont le matériel génétique a été modifié de sorte que le développement et l’implantation dans l’utérus ne sont pas possibles. Il vise à créer des entités de l’embryon comme si ce ne sont pas vraiment des embryons mais qui peuvent être une source de cellules souches pluripotentes. ANT, jusqu’ici seulement testé avec blastocystes de souris, pourrait permettre la création de cellules souches embryonnaires sans détruire un blastocyste humain viable. Certains de ceux qui s’opposent à la recherche sur les cellules souches embryonnaires soutiennent la recherche ANT parce que le blastocyste résultant ne pourrait jamais se développer en un être humain complet et ne pourrait donc pas avoir le statut moral de l’embryon humain. Toutefois cette procédure est inacceptable pour certains autres parce qu’ils croient que cela implique la création d’un blastocyste imparfait qui est conçu pour être détruit.
3) reprogrammer une cellule adulte pour agir comme une cellule souche embryonnaire : Pendant le développement les cellules deviennent de plus en plus spécialisées, elles perdent progressivement la capacité de tourner sur les gènes qui permettent aux cellules souches embryonnaires d’être tellement polyvalente. Le silence de ces gènes semble être responsable du maintien de cellules spécialisées, et de limiter les capacités de différenciation des cellules souches adultes. Par «reprogrammation» des cellules adultes, afin qu’elles puissent se retourner sur les gènes qui permettent la polyvalence, les scientifiques espèrent les faire revenir à un état plus souple. Il est même possible que les scientifiques pourraient un jour « reprogrammer » toute cellule, non seulement des cellules souches. Cependant la recherche dans ce domaine est dans les premiers stades et les scientifiques peuvent être de nombreuses années loin de faire d’une cellule adulte aussi polyvalente qu’une cellule souche embryonnaire.
Chapitre 2: la composition chimique de l’ADN
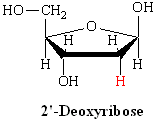
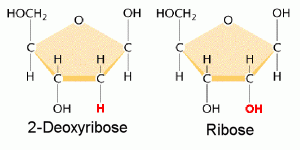
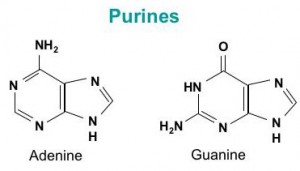
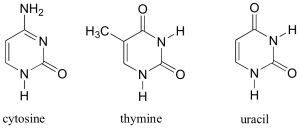
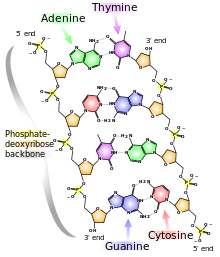
L’ADN est un polymère (une grande molécule qui contient des unités répétitives) composé d’un 2′ désoxyribose (un sucre à cinq carbones), d’un acide phosphorique et de 4 bases azotées notés A, T, G et C. Les structures chimiques des bases sont indiquées ci-dessous. Notez que deux des bases ont une structure à double anneau appelées purines. Les deux autres bases ont une structure à anneau unique, celles-ci sont appelées pyrimidines.
Les bases purines sont l’adénine (A) et guanine (G).
Les bases pyrimidiques sont la thymine (T) et la cytosine (c).
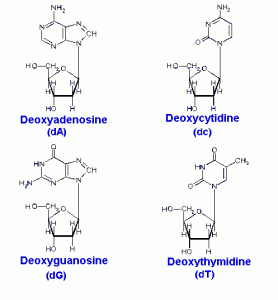
Dans l’ADN chaque base est liée à une molécule du sucre (désoxyribose) formant un composé appelé nucléoside.
Quand un groupe phosphate est également attaché à la molécule du sucre le nucléoside devient un nucléotide.
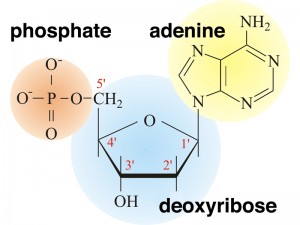
Ainsi un nucléotide est un nucléoside plus un phosphate. Dans la numérotation conventionnelle des atomes de carbone dans le sucre, l’atome de carbone auquel est attaché la base est le carbone 1′ (les atomes dans le sucre ont des numéros primes pour les distinguer des atomes dans les bases).
Dans les acides nucléiques, comme l’ADN et l’ARN, les nucléotides sont joints pour former une chaîne polynucléotidique dans laquelle le phosphate attaché à l’extrémité 5′ d’un carbone d’un sucre est lié au groupe hydroxyle fixé à l’extrémité 3′ de carbone du sucre suivant en ligne. Les liaisons chimiques par lesquelles les composants de sucre de nucléotides adjacents sont reliés par l’intermédiaire des groupes phosphate sont appelées liaisons phosphodiester.
L’orientation 5′-3′-5′-3 ‘de ces liens se poursuit tout au long de la chaîne formant un groupe 5′-phosphate (5′-P) à une extrémité et un groupe 3′-hydroxyle (3′-OH) à L’autre. L’asymétrie des extrémités d’un brin d’ADN crée une polarité dont le sens est déterminé par ces extrémités 5′ phosphate et 3′ hydroxyles.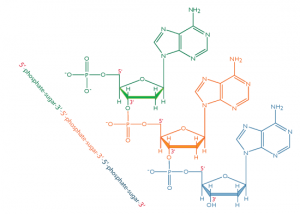
Trois ans avant la proposition de la structure tridimensionnelle essentiellement correcte de l’ADN par Watson et Crick comme une double hélice, Erwin Chargaff avait développé une technique chimique pour mesurer la quantité de chaque base présente dans l’ADN. Comme nous décrivons sa technique nous allons représenter la concentration molaire de chaque base par le symbole de la base entre crochets; par exemple, [A] désigne la concentration molaire de l’adénine. Chargaff a utilisé sa technique pour mesurer la [A], [T], [G] et [C] dans le contenu de l’ADN à partir d’une variété de sources. Il a constaté que dans la composition des bases de l’ADN, la quantité de G + C était constante dans toutes les cellules de l’organisme et à l’intérieur d’une espèce mais différait d’une espèce à l’autre.
Chargaff a également observé certaines relations régulières entre les concentrations molaires des différentes bases. Ces relations sont maintenant appelées les règles de chargaff:
La quantité d’adénine est égale à celle de thymine : [A] = [T].
La quantité de guanine est égale à celle de cytosine : [G] = [C].
La quantité des bases puriques est égale à celle des bases pyrimidiques : [A] + [G] = [T] + [C].
Bien que la base chimique de ces observations n’était pas connue à l’époque, l’une des caractéristiques intéressantes de la structure de Watson-Crick des brins complémentaires appariés était exactement ce qui était expliqué par les règles de Chargaff. Parce que A est toujours jumelé avec T dans l’ADN double brin il doit suivre ce que [A] = [T]. De même parce que G est appariée avec C, [G] = [C]. La troisième règle suit par addition des deux autres : [A] + [G] = [T] + [C].
La structure physique de la double hélice :
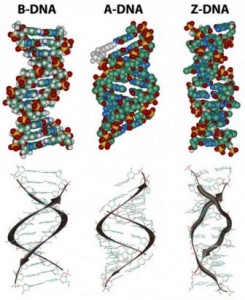
Dans la structure tridimensionnelle de la molécule d’ADN proposé en 1953 par Watson et Crick, la molécule est constituée de deux chaînes polynucléotidiques subissant une torsion,l’une autour de l’autre pour former une hélice double brin dans laquelle l’adénine, la thymine, la guanine et la cytosine sont appariées dans des brins opposés. Dans la structure standard, appelée la forme d’ADN B, chaque chaîne fait un tour complet tous les 34 A°.
L’hélice est droitière ce qui signifie que, quand vous regardez le long de la structure de l’ADN, chaque chaîne suit un chemin dans le sens horaire à mesure qu’elle progresse. Les bases sont espacées à 3,4 A donc il y a dix bases par tour d’hélice dans chaque brin et dix paires de bases par tour de la double hélice. Chaque base est jumelée à une base complémentaire dans l’autre brin par des liaisons hydrogène, qui fournissent la principale force maintenant les brins ensemble (une liaison hydrogène est une liaison faible dans laquelle deux atomes chargés négativement partagent un atome d’hydrogène). Les paires de bases sont planes, parallèles entre elles et perpendiculaires à l’axe longitudinal de la double hélice.
Lors de l’examen d’une molécule d’ADN les biologistes moléculaires font souvent référence à des brins individuels, comme simples brins ou l’ADN simple brin et à double hélice comme l’ADN double brin ou à une molécule duplex. Les deux rainures en spirale à l’extérieur de la double hélice ne sont pas symétriques, une rainure, appelée le grand sillon, est plus grande que l’autre qui est appelée le sillon mineur. Les protéines qui interagissent avec l’ADN double brin ont souvent des régions qui entrent en contact avec les paires de bases en s’ajustant dans le grand sillon, dans le petit sillon ou dans les deux rainures.
L’élément central de la structure de l’ADN est l’appariement des bases complémentaires A avec T et G avec C. Les liaisons hydrogène qui se forment dans la paire de bases adénine-thymine et dans la paire guanine-cytosine sont illustrées sur la figure ci-dessus notez qu’une paire A-T a deux liaisons hydrogène et qu’une paire de G-C a trois liaisons hydrogène. Cela signifie que la liaison hydrogène entre G et C est plus forte dans le sens où il faut plus d’énergie pour rompre, par exemple la quantité de chaleur nécessaire pour séparer les brins appariés dans une ADN duplex augmente avec le pour cent de G + C parce que rien ne limite la séquence de bases dans un seul brin, toute séquence peut être présente le long d’un brin. Ceci explique l’observation de Chargaff que l’ADN de différents organismes peut avoir différentes compositions de base. Cependant parce que les brins de l’ADN duplex sont complémentaires, règles de Chargaff de [A] = [T] et [G] = [C] sont vraies quelle que soit la composition des bases .
Chaque épine dorsale dans une double hélice se compose de sucres désoxyribose alternant avec des groupes phosphate qui lie l’atome de carbone 3′ d’un sucre à l’atome de carbone 5′ du sucre suivant sur la ligne. Les deux brins polynucléotidiques de la double hélice sont orientés dans des directions opposées dans le sens que les bases qui sont appariés sont liés aux sucres respectivement au-dessus et en-dessous du plan de couplage. Ce décalage existe parce que les liaisons phosphate dans les ossatures courent dans des directions opposées et les brins sont dits antiparallèles. Cela signifie que chaque extrémité de la double hélice possède un groupe 5′-P (sur un brin) et un groupe 3′-OH (de l’autre brin) comme le montre la figure ci-dessous :
Les diagrammes des ADN duplex sont statiques et donc quelque peu trompeurs. En réalité l’ADN est une molécule dynamique constamment en mouvement. Dans certaines régions les brins peuvent se séparer brièvement puis se réunir à nouveau dans la même conformation ou dans une autre. Bien que la double hélice droitière est la forme standard l’ADN peut constituer plus de 20 variantes légèrement différentes d’hélices droitières et dans certaines régions peut même exister des hélices dans lequeles les brins sont gauchers (appelées la forme Z de l’ADN) . S’ il y a des tronçons complémentaires de nucléotides dans le même brin et, si ce brin est séparé de son partenaire, il peut se replier sur lui-même comme une épingle à cheveux. Même les triples hélices composées de trois brins peuvent se former dans les régions de l’ADN qui contiennent des séquences de base appropriées.
Qu’est ce qu’un matériel a besoin pour jouer le rôle de transmission génétique ?
Chaque polymère ne serait pas utile comme matériel génétique. Cependant l’ADN est admirablement adaptée à une fonction génétique parce qu’elle satisfait aux trois exigences essentielles d’un matériel génétique. Premièrement, tout le matériel génétique doit pouvoir être reproduit avec précision de sorte que l’information qu’il contient soit précisément reproduit et hérité par les cellules fille. Dans l’ADN cela se fait au moyen d’un code génétique dans lequel des groupes de trois bases spécifient les acides aminés. Du fait que les quatre bases dans une molécule d’ADN peuvent être disposées dans un ordre quelconque et parce que la séquence peut varier d’une partie de la molécule à l’autre et d’un organisme à l’autre, l’ADN peut contenir un grand nombre de régions uniques, chacun d’eux pouvant être un gène distinct. Une longue chaîne d’ADN peut diriger la synthèse d’une grande variété de molécules de protéines.
Un matériel génétique doit aussi être capable de subir des mutations occasionnelles dans lesquelles l’information qu’il porte est modifiée. En outre les molécules mutantes doivent être capables de se répliquer aussi fidèlement que la molécule parentale de sorte que les mutations deviennent héréditaires. Watson et Crick ont suggéré que des mutations héréditaires pourraient être possibles dans l’ADN par mauvais appariement rare des bases avec le résultat qu’un nucléotide incorrect est incorporé dans un brin d’ADN en répliquation.