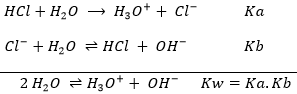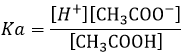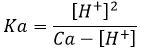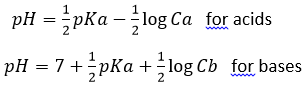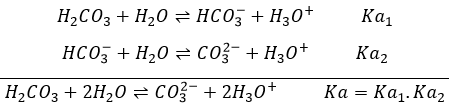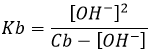La définition générale d’un acide est donc un composé libérant des protons. Toutefois, tous les acides n’ont pas la même force ou acidité. Nous pouvons définir deux types d’acides et bases : des acides et bases forts et des acides et bases faibles. Pour plus de simplicité, nous allons nous concentrer sur les acides dans cette leçon, mais le principe est identique pour les bases.
Les acides forts
Les acides forts se dissocient totalement en solution. Cela signifie que toute molécule d’acide mise dans l’eau permettra de libérer un proton et d’acidifier la solution. Par exemple, HCl est un acide fort.
Si une mole de HCL est mise dans l’eau, tout le HCL se dissocie en solution et nous ne pouvons plus trouver de HCL mais plutôt une mole de Cl- et une mole de H3O + . Pour ce genre de réaction la flèche séparant les réactifs des produits est une simple flèche allant de gauche à droite. Comme la réaction va seulement dans un sens, le potentiel hydrogène ou pH, peut donc tout simplement être trouvé avec la quantité de HCL mise en solution. pH = -log [H3O +] et dès que la réaction est terminée, la quantité de H3O + dans la solution est égale à la quantité de HCL mise en solution. La concentration en protons est donc égale à la concentration de HCL dans la solution avant la réaction [H3O +] = [HCL] 0.
Par exemple, si 0,1 mole de HCL est mise dans l’eau pour obtenir un volume total de 1 litre, [H3O +] = 0,1 mol / l, le pH sera = 1. Au laboratoire, en général, l’acide est déjà en solution avec une forte concentration (par exemple 6 M) et doit être dilué à la concentration désirée pour l’expérience. N’oubliez pas que des précautions doivent être prises lorsque vous manipulez des acides et des bases, en particulier avec les produits concentrés. Utilisez une poire et la pipette et non votre bouche. Une autre règle «sainte» est que «On ne baptise pas un acide », ce qui signifie que pour diluer un acide il faut ajouter l’acide dans l’eau et non l’eau dans l’acide. La raison en est que la dilution d’un acide est fortement exothermique et des gouttelettes d’acide peuvent être éjectées hors du récipient.
L’effet de la dilution sur le pH est simple. Si une solution a un pH = 2 ([H3O +] = 0.01mol / l) elle est diluée 10 fois par rapport à un PH=1(le pH augmente par une unité alors que la concentration diminue de 10 fois) car c’est une échelle logarithmique. et pH = 3 ([H3O +] = 0.001mol / l), etc. Pour les bases, une dilution diminue le pH de la solution à la neutralité (pH = 7). C’ est en effet la concentration de OH qui est affecté dans ce cas. Comme pH = -log [H3O +] = 14 + log [OH-].
En outre, une grande dilution de l’acide n’ entraîne pas une solution basique. La dilution par 100 d’une solution de pH = 6 ne donne pas une solution de pH = 8 mais environ pH = 7. Dans ce cas, l’eau est l’espèce principale définissant le pH. La concentration des protons provenant de l’acide devient négligeable par rapport à la concentration de protons libérés par l’eau.
Pour être considéré comme un acide fort, la constante de dissociation de l’acide doit être suffisamment grande pour transformer toutes les molécules de H2O de la solution en ions H3O +. Formellement les acides forts ont un pKa <-1,74. Nous avons vu que l’eau a une constante de dissociation de Kw=……………… .La constante de dissociation de l’acide est noté Ka. De la même façon que le pH est -log de la concentration en protons, pKa = -log Ka. Par exemple HBr a un pKa de -8,7. La limite de pKa <-1,74 est simplement la concentration de l’eau :
Dans 1l d’eau il y a 1 kg de H2O. La masse molaire de H2O étant égale à 18.01528g, la concentration de l’eau pure est [H2O] = 55,5084. -log De cette concentration est 1,74.
En résumé, pour pouvoir ioniser toutes les molécules d’eau de la solution qui est la condition pour être considéré comme un acide fort, l’acide doit avoir un pKa <-1,74. Certains acides couramment utilisés sont généralement considérés comme des acides forts mais ne répondent pas à cette condition ( ces acides ont un pka comprises entre 0> pKa> -1,74 ) car ils se dissolvent complètement dans la solution diluée. Ce sont les acides presque forts.
Parmi les acides forts, nous pouvons trouver de l’acide chlorhydrique (HCl, l’acide pratiquement fort), de l’acide sulfurique (H2SO4), l’acide nitrique (HNO3, l’acide pratiquement fort), l’acide iodhydrique (HI), l’acide percloric (HClO4), l’acide bromhydrique (HBr) et beaucoup d’autres.
Des exemples de bases fortes : hydroxyde de sodium (NaOH), l’hydroxyde de potassium (KOH), hydroxyde de calcium (Ca (OH) 2), …
La base conjuguée d’acides forts sont des bases très faibles et sont inertes comme base. En effet, la basicité de la base conjuguée d’un acide (et inversement) est liée à la Ka de l’acide. La relation est Ka.Kb = Kw = 10-14. Imaginez une seconde que la base conjuguée réagit avec l’eau. Si l’on ajoute les réactions de l’acide et de sa base conjuguée, nous obtenons la autoprotolyse d’eau:
HCl a un Ka = ![]() et le Kb de Cl- est donc Kb =
et le Kb de Cl- est donc Kb = ![]() .
.
Acides faibles :
Tous les acides ne se dissolvent pas complètement dans l’eau. Les acides avec pKa> 0 sont considérés comme des acides faibles. Étant donné que toutes les molécules d’acide ne se dissolvent pas, il existe un équilibre entre les molécules dissociées et les molécules non dissociées de l’acide.
L’équilibre est représenté par les deux flèches entre les réactifs et les produits.
Un exemple d’acide faible est l’acide acétique (CH3COOH).
En solution, il est donc un mélange de ces quatre molécules. Le pH est toujours déterminé par la quantité de protons en solution. Comment Pouvons-nous déterminer cela dans le cas des acides faibles ?
La constante de réaction de cette réaction est
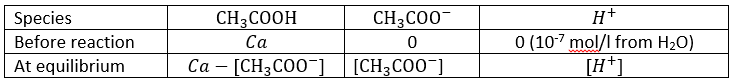
Jetons un oeil à la concentration des espèces avant et après la réaction
Une partie de la concentration initiale de l’acide (Ca) a réagi. La quantité de protons et de la base conjuguée (CH3COO-) produit après la réaction sont égales.
En général, Ca >> [H +], conduisant à la relation suivante.
Le pH de la solution peut donc être trouvé à partir de la concentration initiale de l’acide mis en solution et de son Ka :
Pour bases, la relation est similaire:
Ces relations peuvent aussi s’ écrire :
A partir de ces équations, on peut voir directement pourquoi ce type d’acide est faible en ce qui concerne les acides forts : Pour obtenir une augmentation du pH de 1, un acide fort est dilué par 10 ,tandis qu’un acide faible doit être dilué par 100.
Contrairement aux acides forts, les bases conjuguées d’acides faibles sont actives en tant que base dans la solution. Par exemple, la base conjuguée d’un acide faible avec un Ka = 10-4 a un Kb =10-10 .
Facteurs influants sur l’acidité :
Électronégativité : L’électronégativité se réfère à la capacité des atomes de garder leurs électrons ainsi que les électrons des liaisons qu’ils partagent, près de leur noyau. Pour deux atomes liés ayant la même électronégativité, les électrons qui composent le lien ne sont pas statiques mais ils passent un temps égal à chaque extrémité de la liaison (statistiquement). Pour les deux atomes liés ayant une électronégativité différente, les électrons passent plus de temps dans le voisinage de l’atome d’électronégativité plus grande. Cela génère une séparation des charges, un dipôle avec une charge partielle négative (noté δ-) sur l’élément électronégatif et une charge positive partielle (noté δ +) sur l’élément électropositif. Dans les acides, H possède une charge positive partielle en fonction de l’électronégativité de l’atome auquel il est lié .
Cette charge partielle positive stimule la dissociation de H et augmente ainsi l’acidité de la molécule. Jetons un oeil à la table de Mendeleïev, se déplaçant de gauche à droite sur une même ligne les éléments du tableau périodique deviennent plus électronégatifs (à l’exclusion des gaz nobles) et la force de l’acide formé par ces éléments et les atomes d’hydrogène augmente en conséquence.
Les éléments électronégatifs qui ne sont pas directement liés à l’atome d’hydrogène peuvent également tirer des électrons de l’hydrogène. L’effet est beaucoup plus petit mais ne devrait pas être négligé.
Rayon : les électrons de liaison des atomes plus volumineux sont situés plus loin de leur noyau que ceux de petits atomes. Du fait de cette distance ces électrons sont moins énergétiques : il existe une interaction plus faible avec le noyau et la charge du noyau est partiellement protégée par les électrons des couches internes. En conséquence la liaison est plus facilement cassée pour libérer un proton si l’atome se liant à l’hydrogène est grand. La séquence d’acidité pour les acides halogènes montre cela clairement. HF (acide Hydrofluorous) est un acide faible (pKa = 3,2) et qui est moins acide que HCl, HBr ou HI, même si son électronégativité est supérieure à la leur car elle est beaucoup plus petite (d’un facteur 2 à 3). La liaison entre le fluor et l’hydrogène est donc plus fort parce que les électrons sont à proximité du noyau. HI est le plus grand de la séquence et est aussi l’acide halogène le plus acide avec un pKa de -9,3> pKaHBr (-8,7)> pKaHCl (-6,3)) >> pKaHF (3,2). En descendant une colonne sur la table de Mendeleïev la taille des éléments augmente et deviennt moins électronégative. L’effet de la taille a tendance à dominer la variation de l’électronégativité et de l’acidité des composés portant des atomes d’ hydrogène.
Polyacides :
Plus tôt nous avons mentionné l’acide sulfurique, H2SO4. Cet acide a deux protons disponibles.
Plus haut, nous avons mentionné l’acide sulfurique, H2SO4; cet acide a deux protons disponibles.
H2SO4 est un acide fort (pKa1=-3). Lorsque l’acide sulfurique est mis en solution un premier proton est libéré et il ne devrait pas rester en solution H2SO4. D’autre part HSO4– est un acide faible (pKa2=1.9) et il ne sera pas totalement dissocié dans l’eau. Pour déterminer le pH, nous pouvons procéder comme nous l’ avons fait pour un acide faible:

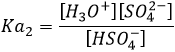 En appliquant les règels mathématiques on peut voir que [HSO4–] = 2Ca- [H3O +] et on peut écrire:
En appliquant les règels mathématiques on peut voir que [HSO4–] = 2Ca- [H3O +] et on peut écrire:
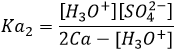
et a partir de cela nous obtenons une équation du second degré :
![]()
qui doit maintenant être résolu pour obtenir :
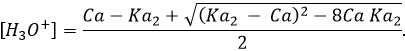
Le pH peut encore être calculé à partir de la constante de dissociation et de la concentration initiale de l’acide mis en solution même si la solution est un peu plus difficile.
Produits amphotériques :
sont des produits qui présentent deux caractéristiques acides et basiques. HCO3– est un exemple de produit amphotérique. Comme l’acide sulfurique H2CO3 est un polyacide. Cependant l’acide carbonique est un acide faible et il existe donc un équilibre impliquant HCO3– en tant que base conjuguée de H2CO3.
L’eau est également une espèce amphotère comme elle peut libérer ou accepter un proton. Il existe un pH particulier auquel l‘espèce amphotère a le même effet que d’une base comme d’un acide. Ce pH est appelé le pH isoélectrique ou PI. Pour H2O dont le pH isoélectrique est de 7 mais il peut être déterminée à partir de la valeur de Ka :
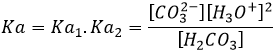
Considérant que [H2CO3]=[ CO32-] à ce pH,
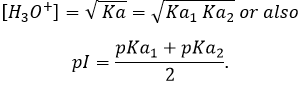
L’acide aminé est une autre espèce amphotère. Ce type de molécule porte un groupe acide et un groupe basique. La figure 1 montre la structure d’un acide aminé : forme acide (à gauche), neutre (au milieu) et la forme de base (à droite). Le groupe acide de l’acide aminé est le groupe COOH. Son atome d’hydrogène peut être libéré afin d’obtenir une charge négative sur l’oxygène. Cette charge est stabilisé par résonance par le groupe COO. Le groupe aminé sur la gauche de la molécule joue le rôle de la base. L’azote possède une paire d’électrons disponibles pour accepter un proton.
Cette propriété amphotère de l’acide aminé est utilisé expérimentalement pour séparer des acides aminés entre eux. En raison de leur structure particulière (R varie en fonction de l’acide aminé), chaque acide aminé a un pH isoélectrique différent. Les molécules sont placées sur un gel contenant un gradient de pH, à l’intérieur d’un champ électrique. Tant que l’acide aminé n’ est pas dans sa forme neutre il est attiré par une électrode placée à une extrémité du gel. Chaque acide aminé cessera donc de se déplacer à un endroit différent sur le gel. Par exemple Alanine (R =CH3) a un pI = 6 alors pi = 5,48 pour la phénylalanine (R=CH2C6H5).
Exercices:
Vous pouvez trouver ici quelques exercices pour appliquer la théorie expliquée dans cette section et, éventuellement, les sections relatives à son sujet. La plupart des questions sont simple à répondre, mais certaines peuvent nécessiter une calculatrice ou être un peu plus compliquées. Les réponses sont données en dessous.
1) Quel est le pH d’une solution de HCl 0,5 M?
2) Comment puis-je proceder expérimentalement pour obtenir 100 ml de HCl 0,05 M?
3) Quel est le pH de cette solution?
4) Si je mets une goutte de cette solution sur un morceau de papier de pH, quelle couleur le papier prendra-t-il?
5) HClO ou (Cl-O-H) est-ce un acide ou une base?
6) Quel est le pH d’une solution à 0,025 M de HClO (pKa = 7,497) ?
7) Si cette solution est diluée par 10 quel sera son pH ? et si dilué par un autre 10 ?
8) Quel est le pH d’une solution de NaOH 0,01 M ? 0,01 M de NH3 (Kb = 1,8 × 10−5) ? A l’équilibre, combien NH3 reste en solution?
Réponses:
1) pH = 0,3: HCl est un acide fort et se dissocie complètement en solution pH = -log [H3O +] = – log [HCl] = 0,3
2) Même si dans ce cas, l’acide n’est pas très concentré il a encore un pH élevé et des précautions doivent être prises pour manipuler une telle solution. Ici, nous avons juste besoin de faire une dilution de la solution acide de 10 fois. Pour obtenir 100 ml de solution diluée, nous aurons besoin d’une pipette de 10ml et sa poire, et une fiole jaugée de 100 ml. On ne baptise pas un acide. Le flacon est donc d’abord rempli avec un volume d’eau (50 ml par exemple) et 10 ml de la solution acide est ajoutée en utilisant la pipette et sa poire. Mélanger la solution et ajouter de l’eau jusqu’ à l’obtention du volume exacte. Mélangez une fois de plus.
3) pH = 1,3: comme la solution initiale a été diluée par 10, pH augmente de 1. Pas besoin de calculer ici.
4) Rouge foncé
5) HClO est un acide : il a été expliquée en détail dans la section précédente : dans HClO (Cl-OH) la différence d’électronégativité entre Cl-O est plus grand que celui entre OH. L’acide hypochloreux se divise en ClO- et H +.
χ–Cl=3.16, χ–H=2.2, χ–O=3.44
6) pH = 4,55. L’acide hypochloreux est un acide faible. La formule de pH est alors :
![]() 7) PH = 5,05 pour une dilution par 10 et 5,55 pour une dilution par 100.
7) PH = 5,05 pour une dilution par 10 et 5,55 pour une dilution par 100.
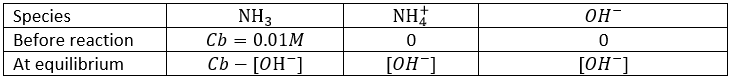
8) NaOH: pH = 12, NH3: pH = 10,63, [NH3] = 0.009576M. Nous pouvons ici simplement utiliser la formule des bases faibles pour le NH3 (rappelez-vous que le pKa + pKb = pke), mais nous aurons besoin des détails de la troisième partie de la question développons le problème :
Considérant que Cb >> [OH-] et nous allons voir que cette approximation est correcte, nous trouvons :
Donc, à partir du 0,01 M de NH3 qui a été mis en solution seulement ~ 4% dissocier. La concentration résiduelle de NH3 est [NH3] = 0.009576M. pH est trouvé en utilisant pH = 14 + pOH = 10,63.