La chimie organique est la chimie du carbone et de ses composés. Le carbone est un élément de le tableau de Mendeleïev parmi beaucoup d’autres, alors pourquoi y a t-il une section complète de la chimie liée à cet élément particulier ? Le carbone a une valence de 4 et peut donc se lier avec quatre autres éléments de la classification périodique. Jusque là, il n’y a rien d’extraordinaire. Toutefois, lorsque les atomes de la chimie inorganique ne se lient ensemble que pour former de petites molécules, des molécules à base de carbone peuvent former de longues chaînes stables avec une riche variété de groupes fonctionnels.
La chimie organique est appelée ainsi parce que le carbone est le constituant essentiel des espèces vivantes : les protéines, l’ADN, les lipides, les sucres ou les graisses sont quelques exemples de composés organiques. Ces composés ont une structure de carbone portant des groupes fonctionnels leur permettant d’interagir ensemble, devenir non seulement une simple addition d’atomes, mais pour former un macrosystème de fonctionnement où chaque molécule a un rôle spécifique à maintenir un corps vivant stable.
La chimie organique est donc très importante dans la science de la vie mais n’ est pas limitée à cela. On trouve le carbone dans le plastique , l’huile, le dentifrice, les shampooings, les vêtements, des déodorants, etc. tous ces produits et bien d’autres sont des composés organiques.
Pour nous aventurer dans ce vaste monde qui est la chimie organique, nous allons d’abord discuter sur les alcanes, leurs structures, leur appellation scientifiques , et leur représentation spaciale. Plus tard, nous allons présenter les différents groupes fonctionnels que nous pouvons trouver sur les composés organiques et enfin comment les composés organiques réagissent, comment nous pouvons les produire ou les modifier.
Alcanes
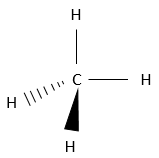
Les alcanes sont des composés constitués uniquement d’atomes de carbone et d’hydrogène. L’hydrogène a une valence de 1, ce qui signifie qu’il ne peut faire qu’une seul liaison avec un autre atome. Un seul carbone va donc se lier à 4 atomes d’hydrogène pour former une espèce neutre CH4. Cette molécule est appelée méthane et dans des conditions normales est un gaz. Les liaisons sont des liaisons covalentes. Le carbone est légèrement plus électronégatif que l’hydrogène, mais il n’ est pas important à ce moment de la leçon. N’oubliez pas que CH4 ne peut pas se dissocier pour donner un proton et n’est donc pas un acide.
Il ya plusieurs façons de représenter cette molécule. La représentation entièrement développée est la suivante :
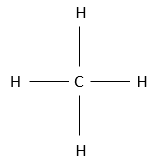
Dans cette représentation du méthane, toutes les liaisons sont représentés par des lignes reliant les atomes. Tous les atomes sont présentés indépendamment ainsi. Cette représentation est en deux dimensions mais en réalité les positions des atomes d’hydrogène en 3D ne sont pas dans un plan unique. La structure moléculaire avec la plus faible énergie est la structure dans laquelle les atomes d’hydrogène sont les plus séparés (éloignés) les uns des autres. En effet, les atomes d’hydrogène ont un volume donné et se repoussent mutuellement. Pour obtenir cette structure un angle de 109,5° sépare les liaisons. Elle conduit à une structure tétraédrique.
La plupart du temps il est inutile de montrer la structure compliquée de grosses molécules. Cela ne ferait que rendre plus difficile de voir les informations importantes de la molécule. Cependant il est parfois important de savoir dans quelle direction va une liaison particulière. Dans ce cas les lignes, représentant les liaisons, prennent des formes différentes en fonction de leur orientation. Dans le plan de la page, les liaisons sont encore représentées par une ligne simple. Deux autres cas sont possibles : Les liaisons peuvent aller dans le sens du lecteur ou dans le sens opposé. Les liaisons allant vers le lecteur sont représentées par un triangle noir une crête est reliée à l’atome sur le plan de la page et les deux autres points sont reliés à l’atome situé en dehors du plan. De cette façon le triangle ressemble à une ligne qui va de l’atome situé sur le plan à l’atome situé plus près du lecteur.
Pour les liaisons qui vont dans la direction opposée, les atomes sont reliés par des traits. Pour le méthane il donne la représentation 3D qui suit :
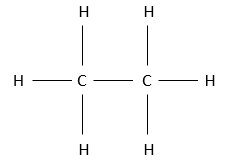
L’alcane possédant une structure de 2 atomes de carbone est l‘éthane. C’est un gaz comme le méthane. Pour former l’ossature de la structure de l’éthane, les deux atomes de carbone se lient ensemble par une liaison covalente. Il est évident qu’ils ont la même électronégativité. Leurs quatre électrons, sont donc utilisés par chaque carbone pour se lier avec l’autre. En outre 6 hydrogènes complètent la structure. Comme dans la chimie inorganique, la règle de l’octet est respectée : pour être stable un carbone doit avoir 8 électrons (un octet) autour d’elle (contraignants ou non) : ses quatre électrons et quatre électrons des autres atomes avec lesquels il partage une liaison. Chaque carbone de l’éthane est donc lié à un atome de carbone et trois atomes d’hydrogène . C’ est la seule structure possible pour un tel composé. En aucun cas un carbone porterait 5 hydrogènes et l’autre carbone 1 ou plus.
La structure pleinement représentée de l’éthane est donc
Si nous voulons la représenter en 3 D, ce serait :
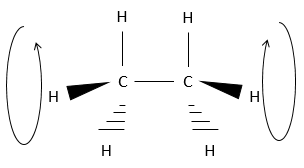
Cependant il faut signaler que les atomes peuvent tourner dans l’axe d’une liaison simple. Les 6 hydrogène se tournent ainsi en cercle autour de l’axe formé par les deux atomes de carbone, comme indiqué ci dessus.
Chaque hydrogène a un volume donné et sent les atomes dans son voisinage (encombrement stérique). Lors de la rotation la distance entre les hydrogènes du même carbone reste constante. Toutefois la distance avec l’hydrogène le plus proche porté par les autres carbones change.
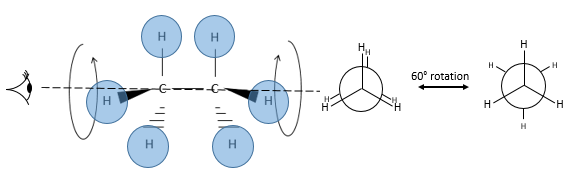
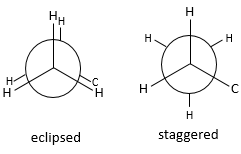
Les positions relatives des substituants peuvent être montrées par la projection de Newman. La molécule est observée le long de son axe C-C. Le premier C (carbone proximal) est représenté par un cercle et à partir du centre de ceci trois lignes sont dessinées vers la périphérie. Ces lignes sont les liaisons de ce carbone. Le second carbone (carbone distal) est caché par le premier, mais une partie de la liaison est visible.
Fixant les hydrogènes du carbone proximal, seulement les hydrogènes du carbone distal peuvent se déplacer. Deux cas peuvent être observés :
– Les hydrogènes du carbone distal et proximal sont sur les mêmes points, et sont » éclipsés »
– Les hydrogènes du carbone distal et proximal ne sont pas sur les mêmes points et sont en quinconce « staggered »
Un maximum d’énergie est atteinte dans la conformation de l’éclipse parce que la répulsion entre les hydrogènes est maximale dans cette conformation. Une rotation de 60° par rapport à cette conformation conduit à un minimum d’énergie car les hydrogènes sont le plus loin possible les uns des autres. Une molécule qui doit maintenir l’hydrogène (ou des substituants) en forme éclipsée a une énergie supérieure par rapport à une molécule de même composition avec des hydrogères sous forme étalée (staggered). La différence d’énergie ici n’ est pas très importante et la rotation est efficace. Pendant la rotation, la molécule passe plus de temps dans la conformation décalée (plus petite énergie). Si les substituants sont sur la molécule, l’encombrement stérique augmente avec le rayon du substituant. Dans certains cas la rotation peut être bloquée par la présence de substituants volumineux.
La semi représentation de l’ éthane est:
Dans cette représentation les atomes de carbone sont regroupés avec les atomes qu’ils portent. Les liaisons entre C et H ne sont donc pas montrées dans cette représentation. Si un atome d’hydrogène a été remplacé par un atome de chlore, par exemple, la semi représentation serait :
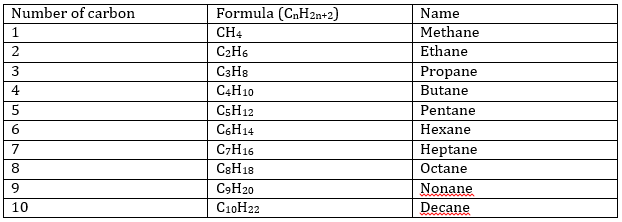
L’ajout d’un troisième atome de carbone à la chaîne donne le C3H8 (propane), qui est encore un alcane linéaire. La structure en triangle où chaque atome de carbone se lie à deux autres carbones existe mais n’est pas stable. Vous avez peut-être remarqué que la formule des alcanes a un modèle général : CnH2n+2. Pour chaque atome de carbone ajouté à la chaine deux atomes d’hydrogène doivent être ajoutés.
Il ya deux façons d’ajouter un quatrième carbone pour obtenir une molécule de butane. La chaîne peut être étendue par le côté ou par son milieu. Lorsque la chaîne est linéaire, on ajoute n- avant le nom du composé. n-butane est donc
![]()
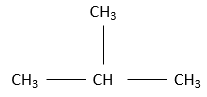
Si la chaîne est prolongée par son milieu, nous nommons ce composé isobutane
Le préfixe iso est utilisé seulement pour quelques composés dans lesquels un carbone terminal peut porter deux bornes CH3. n-butane et l’isobutane ont la même formule C4H10 mais n’ ont pas la même structure. Ce type de composé est appelé un isomère. Plus le nombre de carbone augmente dans un alcane, plus le nombre d’isomères augmente.
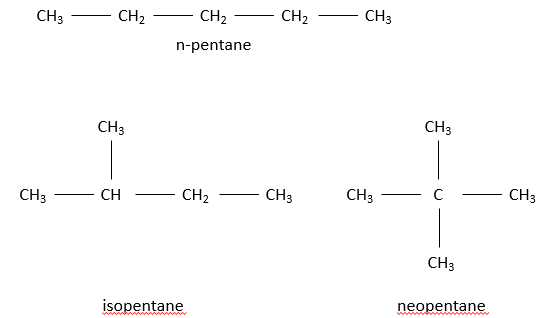
Pour une chaîne de 5 carbones le cinquième carbone peut être ajouté à une extrémité du n-butane pour obtenir un n-pentane et s’il est ajouté à n’ importe quelle extrémité de l’isobutan on obtiendra l‘isopentane par contre s’il est ajouté sur le CH de l’isobutane on obtiendra le néopentane.
Les noms des alcanes :
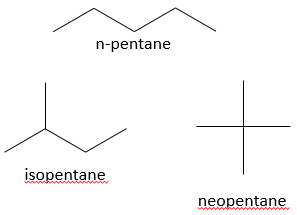
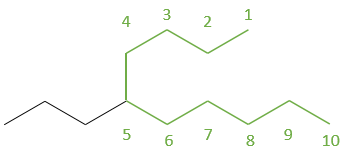
Une autre représentation des molécules organiques est la représentation de l’ossature. Dans cette représentation les atomes de carbone et les atomes d’hydrogène ne sont pas représentés. Les liaisons entre les atomes de carbone sont toujours représentées par des lignes complètes et sont reliés entre eux avec un angle à la position des atomes de carbone. Sans angle nous ne pourrions pas différencier une chaîne de six atomes de carbone d’une chaîne de 7 atomes de carbone. En règle générale l’angle est d’environ 120° de sorte que si un carbone est lié à trois autres espèces (autres que H) chaque liaison soit à égale distance. Si un atome de carbone est lié à quatre espèces l’angle est de 90°.
Par exemple, les pentanes montrés ci-dessous sont représentés :
Cette structure de type ossature est la représentation qui est habituellement utilisée. Seuls les informations importantes sont affichées. Le nombre d’atome d’hydrogène sur les différents atomes de carbone de l’ossature sont déterminés par le nombre de possibilités de liaison que le carbone a. Il est donc inutile de le montrer. En outre cette représentation est plus rapide à écrire et prend moins d’espace.
Il y a une méthode donnée pour nommer les composés organiques. Un alcane en tant que groupe fonctionnel a le même nom sauf que le -ane est remplacé par -yl. Par exemple, l’isobutane est aussi appelé méthylpropane parce qu’un groupe méthyle est fixé à une chaîne linéaire de 3 atomes de carbone, soit une chaîne de propane.
C4H9Cl est un Chlorobutane. Avec ce nom, nous connaissons les composants du composé, mais pas sa structure complète. La connectivité dans le butane et entre le butane et le chlore n’est pas connue.
Les règles pour nommer un composé sont :
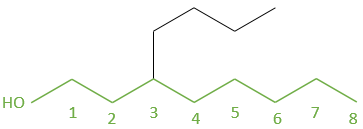
– la plus longue chaîne est la principale toutefois si un groupe fonctionnel est sur une chaîne, la chaîne principale doit le porter.
exemples :
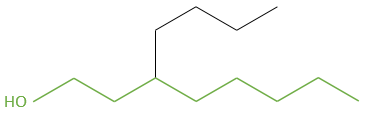
is an octanol
– marquer un numéro à chaque carbone à partir d’un côté de la chaîne principale à l’autre. Le carbone portant un groupe fonctionnel qui est le plus proche d’une extrémité doit avoir le plus petit nombre.
toujours avec les mêmes exemples :
Le carbone portant la petite chaîne de la gauche a le plus petit nombre posssible de cette façon.
Nous énumérons de gauche à droite en raison de la présence du groupe OH sur la gauche. Ensuite nous nommons le composé en écrivant d’abord les groupes sur la chaîne principale avec leur numéro comme préfixe dans l’ordre alphabétique, suivie par la chaîne principale avec son groupe.
les exemples sont ainsi nommés
Si plusieurs groupes fonctionnels identiques sont sur différents atomes de carbone, les préfixes sont séparés par un………, et leur nombre est indiqué par bi, tri, …
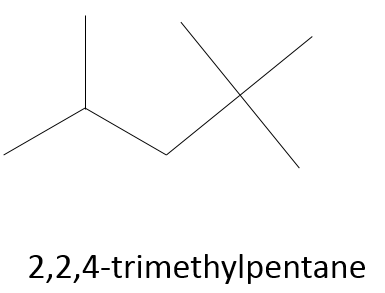
ex : l’iso-octane est le 2,2,4-triméthylpentane ce qui signifie qu’un total de trois groupes méthyle sont sur une chaîne principale de 5 carbones. Deux sont des méthyles sur le carbone N°2 et l’autre sur le N°4. C’est le 2,2,4-triméthylpentane et non 2,4,4-triméthylpentane parce que nous privilégions le carbone portant plusieurs groupes
Halogenoalcanes :
Les halogénoalcanes sont des alcanes portant un ou plusieurs halogènes. Il est simplement dit mais les halogenoalcanes ne sont pas si facilement fait. Ils sont fabriqués à partir d’un alcane dihalogéné et un par une réaction radicalaire au cours de laquelle un proton doit être retiré de l’alcane. Cette étape de la réaction n’ est pas favorable mais peut être faite par chauffage lourd (300° pour le chlorométhane). En outre la position de l’halogène n’est pas complètement résolue. Le proton supprimé pendant la réaction est plus facilemet retiré d’un carbone de la chaîne à une extrémité. Mais la température élevée rend les deux positions possibles (la distribution dépend de la température).
Les halogènes ont une électronégativité supérieure à C et elles génèrent un dipôle de C à X. Un carbone portant un halogène est donc pauvre en électrons et par conséquent peut être ciblé par des réactifs riches en électrons. La réactivité des halogénoalcanes sera vue dans une autre section.
Les molécules chirales :
Nous avons déjà vu que, pour une formule donnée, plusieurs molécules différentes peuvent exister. Lorsque la connectivité diffère, ce sont des isomères de constitution.
Ex : butane et méthylpropane, éthanol et méthoxyméthane.
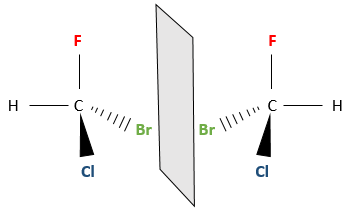
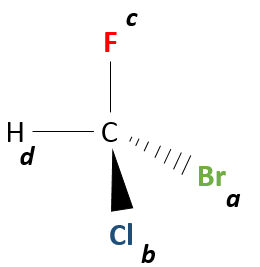
Même sur un seul carbone, la connectivité peut changer. Les stéréoisomères sont des isomères de même connectivité, mais avec le positionnement spatial différent. Le bromochlorofluorométhane a deux formes de stéréoisomères.
Ces deux molécules sont des images en miroir l’une de l’autre. On dit qu’elles sont chirales si la molécule et son image en miroir ne se superposent. Ces stéréo-isomères particuliers sont appelés énantiomères.
Une bonne manière d’expliquer la chiralité est de regarder nos mains. La main gauche est l’image en miroir de la main droite (et vice versa). Cependant nous ne pouvons pas les superposer.
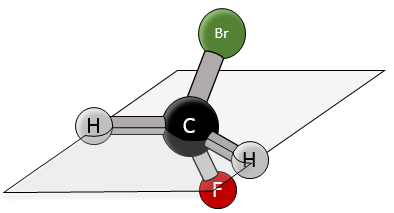
La chiralité est liée à l’atome de carbone qui porte plusieurs groupes différents c’ est un stéréocentre. Les stéréocentres sont souvent signalés par un astérisque. Si un plan de symétrie existe pour la molécule, alors cette molécule est achirale (><chiral) et la molécule et son image en miroir peuvent en quelque sorte se superposer. Par exemple parce que le Bromofluorométhane est achiral un plan de symétrie peut être tiré, en passant par les deux atomes d’hydrogène.
Notre corps est capable de distinguer l’une de l’autre des énantiomères. Pour certains médicaments un énantiomère est actif tandis que l’autre ne fera absolument rien ou sera moins efficace. Dans certains cas, il est donc très important d’être capable de produire sélectivement un énantiomère et pas l’autre. Les industries pharmaceutiques ont investi ces méthodes. Si la réaction n’ est pas énantiosélective, la productivité chute immédiatement de 50%. L’activité optique des énantiomères diffère également et est un bon moyen de savoir quels énantiomères ont été produites.
l’activité optique
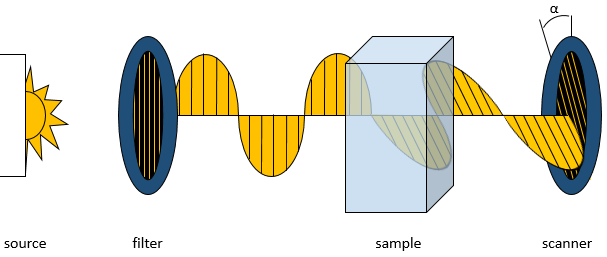
L’activité optique d’un composé est son influence sur un faisceau de lumière polarisée dans un plan. Lorsque la lumière filtrée à osciller uniquement dans un plan, passe à travers un échantillon d’un composé optiquement actif, le faisceau est mis en rotation d’un angle donné.
L’angle de rotation dépend des molécules dans l’échantillon, de leur concentration et de la longueur de la cellule d’échantillonnage. Chacun de ces effets sont linéaires et la modification de l’angle de la lumière est donnée par la formule
L’intérêt de ce phénomène est que les énantiomères n’ ont pas la même activité optique. La modification de l’angle absolu est identique, mais la direction dans laquelle la lumière est mis en rotation ne l’est pas. Un énantiomère dévie la lumière vers la droite et l’autre énantiomère dévie la lumière par exactement le même angle, mais vers la gauche. Les énantiomères sont respectivement définis comme dextrogyre et lévogyre et asont notés avec un (+) ou un (-).
L’activité optique d’un énantiomère est fixée, à une température donnée t et pour une lumière de longueur d’onde λ donnée. En connaissant la valeur de l’activité optique, il est possible de déterminer la quantité de chaque énantiomère dans un mélange racémique. Un mélange racémique est une solution contenant les deux énantiomères, pas nécessairement dans la même quantité (nb : une définition plus globale d’un mélange racémique est le mélange de plusieurs produits possibles d’une seule réaction). Dans un tel mélange, toutes les espèces dévient la lumière par leur effet normal.
Si les deux énantiomères sont en quantités égales dans la solution l’échantillon sera optiquement inactif, l’effet sur un énantiomère étant contrebalancé par l’effet de son image spéculaire (ie l’autre énantiomère). Si les quantités ne sont pas égales l’échantillon est optiquement actif et les quantités relatives des énantiomères peut être déterminée. L’excès énantiomérique est la différence de proportion des deux énantiomères est pratiquement et la proportion des énantiomères qui ont un effet sur la lumière. Par exemple si le rapport entre les énantiomères était de 3: 1 (75% de l’un (disons le dextrogyre) et 25% de l’autre énantiomère) l’excès énantiomérique est de 50%. En effet à partir de 75% de l’énantiomère dextrogyre l’effet de 25% est contrebalancé par l’énantiomère lévogyre présent dans la solution. Seulement 50% de l’énantiomère (+) dévie le faisceau lumineux. Si l’énantiomère pur aurait tourner le plan de lumière de 26°, un excès de 50% entantiomeric la lumière tourne de 13° (50% de 26 °).
Nom des énantiomères :
Nous devons trouver une façon de nommer différemment les énantiomères. R ou C seront précédés par le nom de la molécule et nous allons maintenant voir comment attribuer quelle lettre à quel énantiomère. C’est malheureux mais il n’y a pas de corrélation claire entre le pouvoir rotatoire d’un énantiomère et sa structure. Une autre méthode a dû être trouvée.La première étape consiste à donner une priorité à chaque groupe fixé à un stéréocentre.
La priorité est donnée à l’atome qui a la masse la plus élevée en relation avec le stéréocentre. Appelons ces groupes a, b, c et d par une diminution de la priorité (A a la priorité sur B, B sur C, et C sur D). Si deux atomes ont le même poids (deux atomes de carbone sont liés au stéréocentre par exemple), nous regardons les atomes qu’ils portent et, encore une fois, la priorité va au carbone portant l’atome de poids atomique le plus grand. Si un groupe méthyle et un groupe éthyle sont liés au stéréocentre, l’éthyle a la priorité. Les deux groupes sont liés au stéréocentre par un atome de carbone. Nous étudions maintenant les atomes sur ces carbones. Le méthyl a 3H etl’éthyle a 2H et une C. Comme C est plus lourd que H, l’éthyle a la priorité sur le méthyle.
Rappelez-vous que c’est le poids de l’atome lié au stéorocentre qui compte, pas le poids de l’ensemble du groupe. Un groupe -OH a en effet la priorité sur un groupe éthyle parce que O (poids atomique = 16) est plus grand que C (12), même si les poids des groupes sont respectivement 17 et 29 unités de masse atomique. Notez que nous parlons de la masse des éléments. Les isotopes peuvent ainsi créer des stéréocentres dans les molécules.
Ensuite nous regardons la molécule comme si le groupe avec la plus faible priorité (D) était derrière le carbone. En général le groupe avec la plus petite priorité est un atome d’hydrogène. Cet atome (ou groupe) n’est pas représenté dans le reste du procédé.
Ainsi, en regardant au stéréocentre de cette façon, nous ne voyons que trois liaisons liant le stéréocentre avec les trois groupes de priorité (A, B, C).
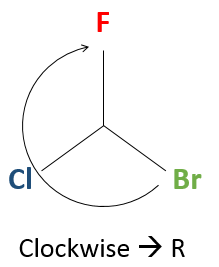
Maintenant nous voulons déterminer dans quel sens faire tourner pour aller de la plus haute priorité (A) à la plus basse (C), en passant par B il peut être utile de placer A en haut de la représentation.
Si nous devons aller dans le sens horaire, c’ est l’énantiomère R. Et si c’est dans le sens antihoraire nous sommes en présence de l’énantiomère S.
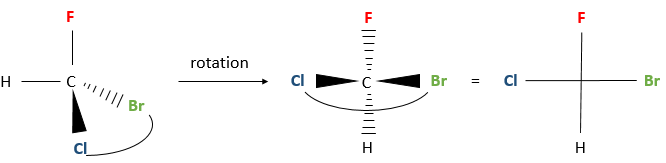
Une deuxième méthode existe ce qui donne les mêmes résultats en utilisant la projection de Fisher.
Au lieu de placer un groupe derrière le stéréocentre on met deux groupes horizontaux et vers le lecteur par une rotation du stéréocentre. Les deux autres groupes sont sur l’axe vertical et à l’opposé du lecteur.
La rotation du stéréocentre est effectuée par « saisir » une paire ou des substituants et de les placer en face de la molécule. Faire attention à placer les groupes dans la direction horizontale du lecteur et les verticales dans la direction opposée. Sinon un énantiomère R est S et inversement.
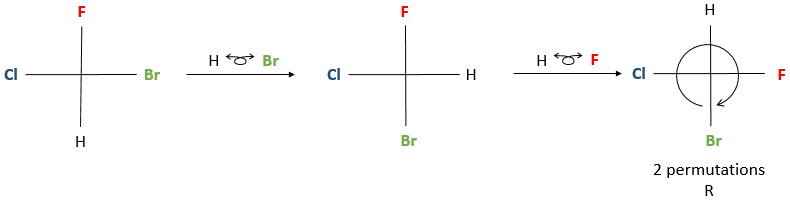
Une fois que la rotation s’ effectue, afin de déterminer la configuration correcte, le groupe de priorité la plus basse doit être placé sur 12 heures de position de la représentation Fisher. Ensuite la configuration est déterminée de la même manière que pour la projection de Newman. Si le groupe de priorité la plus basse n’était pas en position haute après la rotation, ne vous inquiétez pas, nous pouvons effectuer des permutations entre les substituants voisins. L’exécution d’une permutation modifie la conformation de l’énantiomère R à S et inversement. Exécution de deux permutations laisse l’énantiomère identiques.
Si un nombre pair de permutations (y compris zéro) ont été faites pour mettre le groupe de priorité la plus basse dans la position de 12 heures, nous pouvons déterminer directement la configuration de l’énantiomère. Si un nombre impair de permutation a été fait alors nous avons deux choix: soit nous déterminons la configuration actuelle, sachant que la configuration correcte est l’autre, ou nous faisons une permutation supplémentaire et ensuite nous déterminons la configuration.
diastéréoisomères
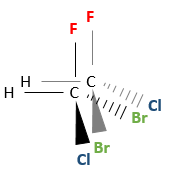
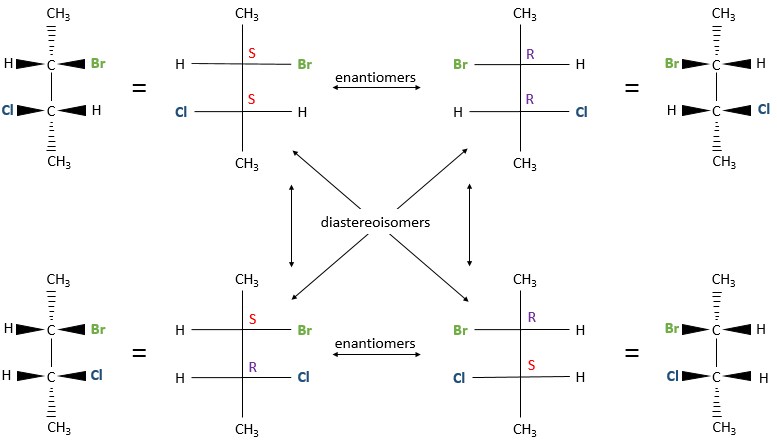
Plusieurs stéréocentres peuvent être présents sur une seule molécule. La configuration de chaque stéréocentre (R ou S) est déterminée de façon indépendante. Si deux stéréocentres sont sur une molécule plusieurs configurations sont possibles : RR, SS, RS et SR.
Par exemple le 2-bromo-3-chlorobutane a quatre stéréoisomères.
Toutes ces conformations ne sont pas des images en miroir l’une de l’autre. Certains sont stéréoisomères énantiomères mais certains ne sont pas. Les stéréoisomères qui ne sont pas l’image miroir de l’autre sont appelés diastéréoisomère.
Exercices :
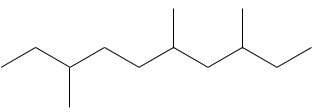
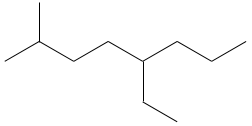
Dessiner les structures d’ossature des isomères de C8H18. Combien d’isomères avez-vous trouvé?
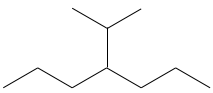
Nommez les molécules suivantes :
3. Dessinez la molécule suivante :
3,6,10-triméthyldodecane
5-éthyl-2-méthyloctane
2,6-diméthyle-4,5-dipropylnonane
4- (1-méthyléthyl) heptane
Est-ce le nom correct ? Si non, corrigez.
2,5-diméthyle-4,6-dipropylnonane
3-éthyle-7-méthyloctane
2,5-diméthyle-4-éthyldecane
4- (1-méthyléthyle) -5-propyldecane
Dessinez les projections Newman des liaisons CC de cette molécule et précisez s’ils sont éclipsés ou décalés
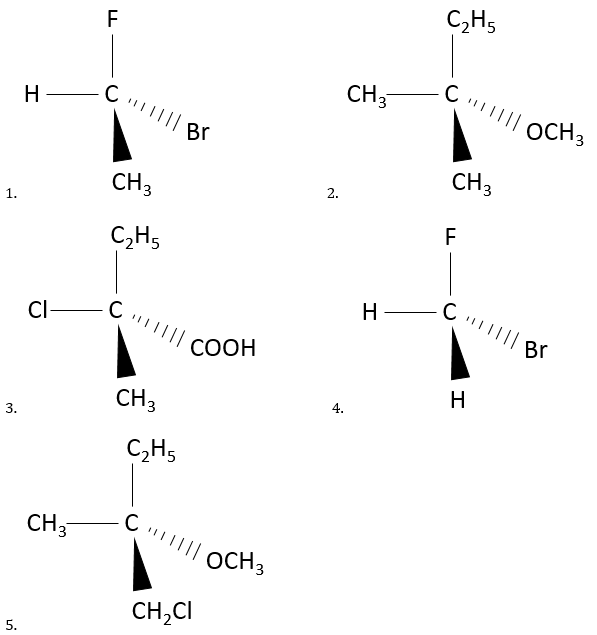
6. chiral ou achiral ? Si chiral, indiquez s’ils sont R ou S.
Réponses
1. Il ya 23 isomères de constitution pour C8H18. Une bonne façon de les trouver tous est de commencer par la plus longue chaîne principale et diminuer sa longueur étape par étape.
2. Noms :
2,1: n-hexane
2,2: Néopentane 2,2 ou 2,2-diméthylepropane
2,3: 4-éthyle-7-méthyledécane. Ce n’est pas le 4-méthyle-7-éthyledécane car les substituants sont placés dans l’ordre alphabétique s’ils sont à la même distance d’une extrémité de la chaîne
2,4 : 6-propyle-3-méthyledécane (de la chaîne principale de haut en bas à droite)
2.5: 5- (1-méthylepropyle) décane
2,6 : 4-éthyle-4-méthyloctane
3. Noms et esquisse:
3.1: 3,6,10-triméthyledodécane
3.2 : 5-éthyle-2-méthyloctane
3.3: 2,6-diméthyle-4,5-dipropylnonane
3.4: 4- (1-méthyléthyle)heptane
4. correcte ou non?
2,5-diméthyl-4,6-dipropylnonane: correct
Incorrect:: 7-méthyloctane-3-éthyl le substituant méthyle est plus proche d’une extrémité de l’éthyle. Le nom correct est 6-éthyl-2-méthyloctane
2,5-diméthyl-4-ethyldecane: incorrecte: substituants doivent être nommée dans l’ordre alphabétique. Le nom correct est 4-éthyl-2,5-dimethyldecane
4- (1-méthyléthyl) -5-propyldecane: correct
5. projections Newman allant de gauche à droite
6. Chiralité:
6,1 chirale: R
6,2 Achirale
6,3 chirale: S
6,4 Achirale
6,5 chirale: S
( cet article a été-traduit de l’anglais cf site en aglais de BORZUYA university )