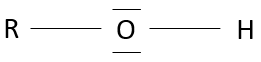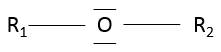Autres que les alcanes, les alcènes, les alcynes et les halogénoalcanes, il existe un grand nombre de groupes fonctionnels que l’on peut trouver dans la chimie organique. En cette première année nous allons seulement jeter un coup d’oeil sur la richesse de la la chimie organique à travers les groupes fonctionnels qu’une chaîne d’hydrate de carbone peuvent porter et de certaines de leurs propriétés. Nous n’ allons pas encore parler de leur réactivité ou de la façon de les produire.
Fondamentalement les principaux atomes dans le biosphère et en chimie organique sont le C, H, O et N. Les groupes fonctionnels sont habituellement faits de O et/ou de N mais parfois aussi d’autres atomes.
Les groupes basés sur O
Il ya beaucoup de groupes fonctionnels qui contiennent des atomes d’oxygène. Les groupes contenant le N et le O seront étudiés dans le chapitre consacré aux groupes basé sur N .
L’oxygène est capteur inductif et donneur mésomérique. Capteur inductif signifie qu’il attire les électrons des atomes de carbone adjacents en raison de son électronégativité. Donneur mésomérique signifie que l’oxygène peut partager une seule paire (électrons) avec le reste de la molécule, pour former finalement des structures de résonance.
Les alcools :
les alcools sont des molécules portant un groupe OH sur un carbone.
Nomenclature : ajouter -ol précédé de la position du groupe. Par exemple l’éthanol est le propan-2-ol, éthane-1,2-diol.
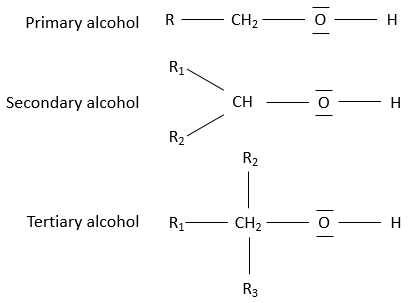
Les alcools peuvent être subdivisés en trois groupes en fonction du nombre de chaînes sur le carbone portant l’alcool :
Alcool primaire : Une chaîne est liée à l’atome de carbone. La formule générale est R-CH2OH.
Alcool secondaire: deux chaînes sont liées au carbone. La formule générale est R1R2-CHOH.
Alcool tertiaire : Trois chaînes sont liées au carbone. La formule générale est R1, R2, R3-COH.
propriétés :
Les alcools sont des acides faibles (pKa ~ 16-18). L’acidité diminue des alcools primaires aux alcools tertiaires parce que les chaînes partagent leurs électrons par effet inductif vers l’O. La charge de la base conjuguée de l’alcool est donc augmentée par la présence de chaînes sur le carbone. Une plus grande charge signifie que la base conjuguée est moins stable et sera probablement moins produite par la dissociation du proton, par conséquent la diminution de l’acidité. En outre les chaînes augmentent la taille de la molécule ce qui diminue la solvatation de l’ion, cela diminue aussi l’acidité de l’alcool.
Ils sont de bons nucléophiles : les paires libres de l’oxygène peuvent attaquer des cibles électrophile.
Les alcools peuvent accepter et faire des liaisons hydrogène.
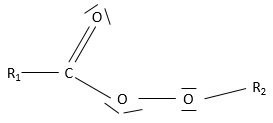
Les éthers :
un éther est un groupe dans lequel un atome d’oxygène est relié à une seconde chaîne : R1-O-R2. Remarquez R1 peut être identique à R2 ce qui donne une chaîne cyclique par un hétéroatome (= O).
Deux nomenclatures sont utilisées :
-les noms des chaînes puis de l’éther. Exemples : éther méthylique, l’éther méthylique d’éthyle
-la forme «alcoxy alcane : La plus petite chaîne est la première noté. Exemples: méthoxyméthane, méthoxyéthane, éthoxypropane
propriétés
En général les éthers sont volatils et ont un point d’ébullition bas.
Ils peuvent être protonés, puis former un bon groupe partant pour une SN2. Les éthers sont souvent utilisés pour protéger un groupe que nous ne voulons pas remplacer: former l’éther, procéder à la substitution dans des conditions de base, et éliminer l’éther.
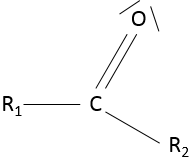
Les cétones :
une cétone est une double liaison entre un atome de carbone et un atome d’oxygène au milieu d’une chaîne : R1-C (= O) -R2
Nomenclature : le nom de l’alcane correspondant avec le suffixe one. Par exemple CH3COCH3 : propan-2-one. Notez que pour ce composé particulier un nom commun est préféré : acétone.
propriétés
Il y a un dipôle entre le C et le O de la cétone. Le C est électrophile alors que O est nucléophile. L’oxygène peut également accepter des liaisons hydrogène.
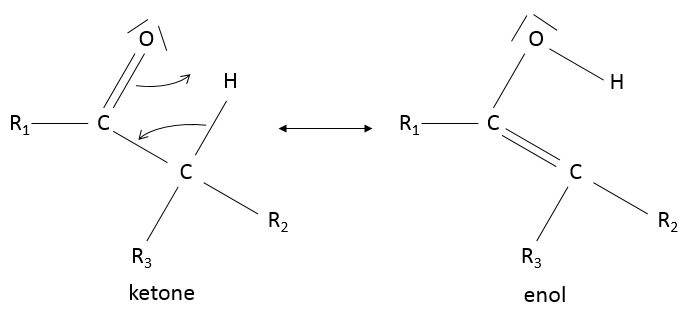
Tautomérie céto-énolique : si un hydrogène est présent sur un carbone voisin de la cétone alors une forme de résonance existe pour la cétone, acide catalysé dans des conditions basiques
En raison de ce processus, les cétones sont acides (pKa ~ 20) : la forme de résonance stabilise la charge négative de la base conjuguée.
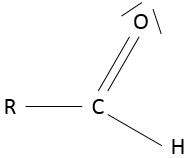
Aldéhyde :
un aldéhyde est similaire à une cétone sauf que c’est à la fin d’une chaîne :
RC (= O) -H.
Nomenclature : pour les chaînes alcanes simples le nom de l’alcane correspondant avec le suffixe (-al) ou -carbaldehyde pour des molécules plus complexes. Si un autre groupe fonctionnel est déjà responsable du suffixe du nom (un alcool par exemple) le préfixe formyle est utilisé à la place. L’extrémité COH est également appelé un groupe formyle et le plus petit aldéhyde HCOH est appelé formaldéhyde.
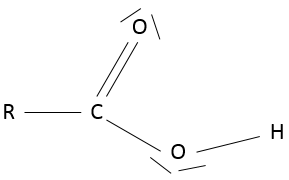
Acide carboxylique :
un acide carboxylique est une cétone qui est lié à un alcool : RC (= O) -OH
Nomenclature : le nom de l’alcane correspondant avec le suffixe (oïque) et préfixe acide. Exemples : l’acide butanoïque, l’acide propanoïque. Cependant il y a plusieurs noms communs pour certains acides carboxyliques provenant de ce que nous avons vu pour les groupes fonctionnels précédents : l’acide formique (HCOOH, de piqûres d’insectes), de l’acide acétique (CH3COOH), l’acide butyrique (CH3 (CH2) 2COOH à partir de beurre ) et beaucoup d’autres.
La base conjuguée d’un acide carboxylique est un carboxylate.
propriétés
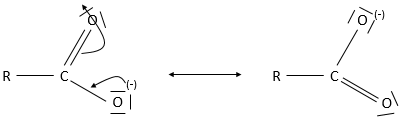
De toute évidence les acides carboxyliques sont des acides. Ils sont plus acides que les alcools et très acides par rapport à d’autres composés organiques. Bien que les alcools ont un pKa d’environ 16 à 18 c-à-d inférieure à celui du pKa de l’eau, l’acide carboxylique est un acide faible avec un pKa compris entre 3-5. Cette acidité provient des formes de résonance du carboxylate, la base conjuguée de l’acide:
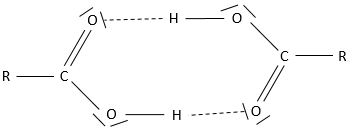
Les acides carboxyliques sont polaires et solubles dans l’eau (et les solvants protiques polaires) mais également dans les solvants non polaires : deux acides peuvent former un dimère non polaire par une liaison hydrogène.
Les esters :
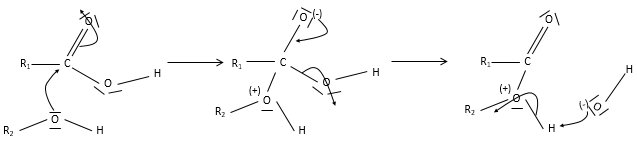
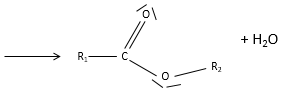
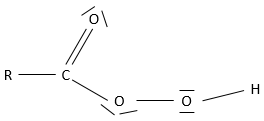
un ester est la combinaison d’un acide carboxylique et d’un alcool (et c’est ainsi qu’on les produit techniquement) : R1-C (= O) -O-R2.
Nomenclature : la chaîne principale est celle qui porte le carboxylate
(RC (= O) -O-) et est nommé avec le suffixe -oate et le reste de la chaîne est un groupe. Exemples : Ethylethanoate (ou acétate d’éthyle), propyloctanoate.
propriétés
Les esters sont polaires et peuvent accepter des liaisons hydrogène.
Les peroxides :
il n’ est pas vraiment un type de groupe mais plutôt comme une modification des groupes existants caractérisée par la liaison de deux atomes d’oxygène.
Le peroxyde lui-même est la modification d’un éther : R1-OO-R2.
L’ hydroperoxyde est le peroxyde d’alcools : ROOH.
Le peracide (ou peroxyacide) est le peroxyde d’acides carboxyliques :
RC (= O) -OOH.
Le perester est le peroxyde d’esters : R1-C (= O) -OO-R2.
Les groupes basés sur N :
comme l’oxygène l’azote est un accepteur inductif et un donneur mésomère.
Les amines :
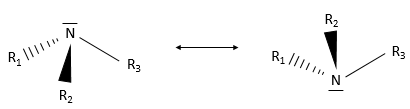
un groupe amine est un atome d’azote lié à une ou plusieurs chaînes carbonées. Les amines primaires sont liées à une chaîne, les amines secondaires à deux chaînes et les amines tertiaires à trois chaînes de carbone. Il existe aussi des amines quaternaires qui portent une charge positive sur l’atome d’azote . Les amines secondaires et tertiaires peuvent être trouvées dans les cycles. La pipéridine qui est très utilisée est un exemple d’amine cyclique.
Nomenclature:
on utilise le préfixe amino ou le suffixe amine. Exemple : 2-aminohexane et méthylamine.
propriétés
Ce sont de bons nucléophiles, en fonction du nombre et de la longueur des chaînes liées. Sauf l’amine quaternaire l’azote a une paire libre et peut osciller entre deux conformations.
Les amines sont des bases : la paire libre peut accepter un proton. La basicité dépend de l’encombrement stérique (et donc de solvatation de l’ion) et sur la nature des chaînes. Les chaînes alkyles améliorent la basicité (par induction) tandis que les chaînes aryle (une chaîne aromatique, voir chapitre suivant) diminuent la basicité (par donation mésomère).
un groupe nitro :
un groupe nitro est composé d’un atome d’azote et de deux atomes d’oxygène. On le trouve principalement sur les cycles aromatiques par addition électrophile (à voir l’année prochaine) et non pas par substitution nucléophile.
Une charge positive et une charge négative sont présentes sur l’azote et sur l’un des deux atomes d’oxygène. En fait il existe deux formes de résonance pour le nitro et les atomes d’oxygène et elles sont équivalentes.
propriétés
le groupe nitro donne des composés explosifs. L’explosif le plus connu est TNT (trinitrotoluène). Ne pas chauffer trop ou trop vite un composé contenant des groupes nitro surtout s’ il y en a plus d’un sur le substrat.
Les amides :
les amides sont l’équivalent d’un ester sauf que l’un des oxygènes est remplacé par un azote : R1-C (= O) -NH-R2.
Nomenclature : le suffixe d’amide est simplement ajouté à la fin du nom du composé. L’équivalent d’acide acétique est l’acétamide.
propriétés
Les liaisons d’hydrogène sont possibles sur l’azote dans les deux directions. La solubilité des amides dans des solvants protiques est bonne. La solubilité est plus faible si l’azote est lié à deux chaînes de carbone (amide tertiaire).
Les amides interviennent comme l’ossature des peptides :
ils ont une structure de résonance séparant les charges.
Les nitriles :
les nitriles sont le groupe fonctionnel composé de C = N. Dans la chimie inorganique ce groupe est appelé cyanide et est très toxique.
Nomenclature : le préfixe cyano est ajouté au nom du composé.
propriétés
Ils sont utilisés pour produire des acides carboxyliques par hydrolyse, ou des amines par hydrogénation catalytique.
Ils sont aussi souvent utilisés pour étendre une chaîne carbonée.
Le carbone des nitriles est électrophile.
Les sulfonates et phosphates :
les préfixes sulfo ou phospho sont ajoutés au nom du composé