Le mot protéine vient du mot grec proteos, qui signifie premier. Les protéines sont en effet un élément essentiel de la vie. Elles sont bien définies dans la composition, la taille et la forme et chacune a un rôle très précis: transport, défense, hormones, … Certaines ont aussi un rôle exotique. Par exemple, certaines protéines empêchent le sang des poissons de geler. Nous pouvons cependant trier les protéines en trois classes principales: les protéines fibreuses, globulaires et membranaires. Les protéines fibreuses sont étirées et fragiles. Deux exemples sont la kératine et le collagène. La kératine est une protéine structurelle fibreuse dure et insoluble qui compose les cheveux, la laine, les cornes, les ongles, les griffes, etc. La ténacité de la kératine est rivalisée seulement par la chitine dans les matériaux biologiques. Ils ne sont pas seulement localisés dans les parties dures des animaux mais se trouvent dans toutes les cellules épithéliales, c’est-à-dire les cellules qui recouvrent les surfaces externes des organismes et les surfaces internes des organes pour renforcer leur structure. Les cornes, les griffes, les ongles … sont produits par des cellules épithéliales adaptées qui ont une quantité abondante de kératine durant leur croissance et après leur mort laissent la kératine pour aider à former une structure précieuse pour l’animal entier. Le collagène est la principale protéine structurelle dans l’espace extracellulaire, ce qui en fait la protéine la plus abondante chez les mammifères. Ils forment des os, des tendons, des cartilages en fonction du degré local de minéralisation. Les protéines membranaires se trouvent dans les membranes et servent de récepteurs ou fournissent des canaux pour transporter des ions ou des molécules d’un côté de la membrane à l’autre. Les protéines globulaires sont essentiellement des protéines non fibreuses et ont des fonctions diverses (exemple: hémoglobine, lysozyme). Toutes les enzymes sont des protéines globulaires.
Un point commun entre toutes les protéines est qu’elles sont insolubles dans les solvants organiques. Grâce à cela, nous avons pu déterminer leur structure (cristalline) et leur composition. Par exemple, dans les os, nous avons trouvé le collagène par cristallisation. Nous pouvons détruire la protéine pour déterminer les acides aminés dont elle est faite: glycol. Dans la soie, nous avons découvert la fibroïne, composée de sérine.
Les acides aminés (AA)
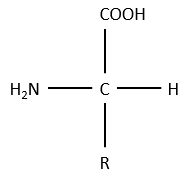
La structure générale des acides aminés est :
où R est le groupe qui fait la distinction entre tous les différents acides aminés (à une exception près). Ce sont des zwitterions: ils portent un groupe acide (COOH) et un groupe basique (NH2). Le carbone central est chiral et l’AA peut être L ou D. 20 AA sont présents dans les protéines (plus de 23 AA).
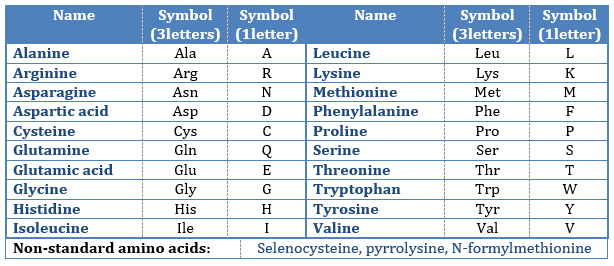
Les AA sont généralement écrits par une abréviation de 3 lettres triées en fonction de leur groupe fonctionnel R
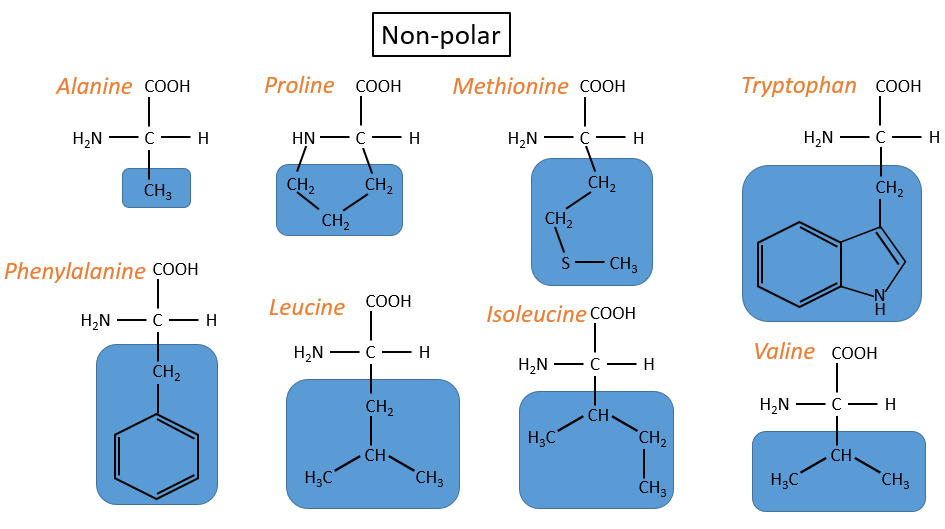
- hydrophobe non polaire: pas d’interaction avec l’eau :
– la proline: son R est cyclique et se lie au groupe amine de l’AA. Il interdit la rotation de l’AA.
-la méthionine: elle possède un atome de soufre
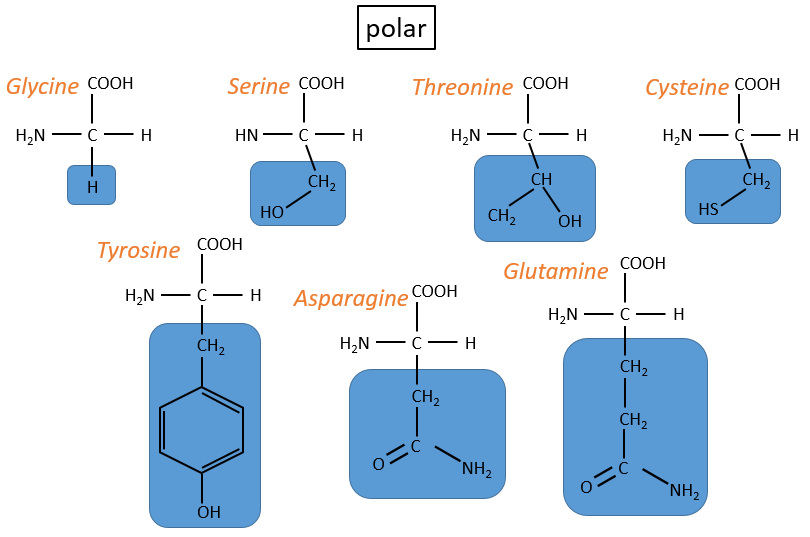
2. neutre polaire: peut réagir avec le solvant. Ils sont polaires parce que R est très petit
-cystéine: ils se lient ensemble via des liaisons S
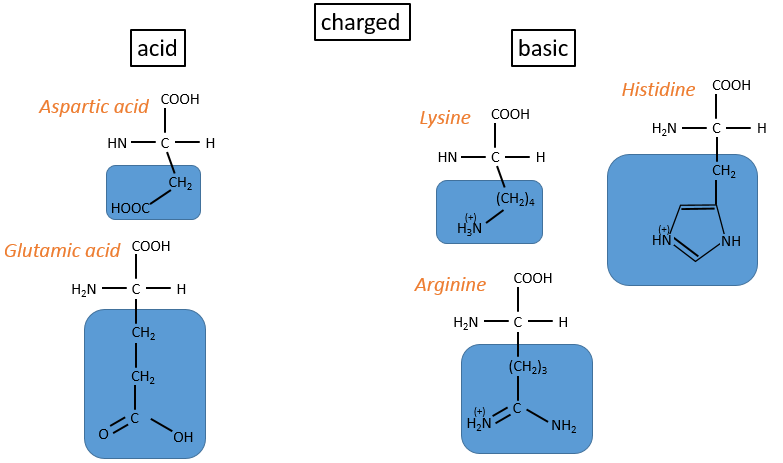
3.chargé polaire
– acides: with COOH
– basiques: with amine derivatives
L’isoleucine et la thréonine ont un carbone asymétrique. Seul le L est naturel.
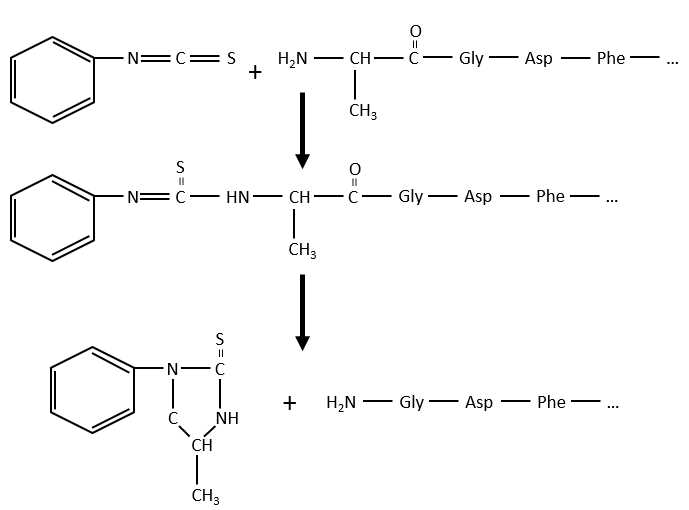
Comme zwitterions, les acides aminés ont un point isoélectrique qui dépend de la nature de R. On peut facilement déterminer la composition d’une protéine grâce à cette propriété: une fois hydrolysés, les acides aminés qui composent la protéine peuvent être séparés par chromatographie ou électrophorèse et déterminer leurs proportions. Il existe également un moyen de déterminer le dernier acide aminé de la protéine (terminé par NH2): avant l’hydrolyse, on utilise le réactif de Sanger (1-fluoro-2-4-dinitrobenzène). Ce groupe coloré est fixé sur l’amine et la liaison ne peut pas être hydrolysée. Nous pouvons donc l’identifier après la chromatographie. Une autre méthode est la dégradation d’Edman. Dans ce cas, un isothiocyanate de phényle réagit avec le résidu amino-terminal pour former un thioamide. La liaison peptidique suivante est affaiblie et peut être clivée sans hydrolyse en raison de la formation d’un cycle.
Le processus peut être répété plusieurs fois pour déterminer la séquence amino-terminale initiale.
Les interactions entre l’AA de la protéine avec l’autre AA et avec le solvant sont responsables de la structure de la protéine.