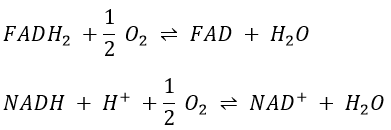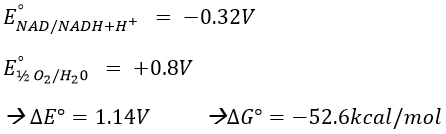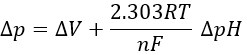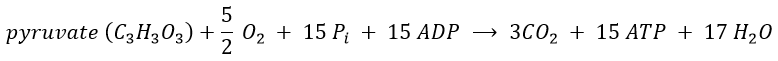En 1935, Engelhardt a analysé le taux d’ATP dans les globules rouges en fonction du taux d’oxygène. Les expériences ont montré que l’ATP augmente avec la quantité d’O2. Contrairement à la levure, les cellules sanguines devaient être en une seule pièce pour observer le phénomène. Plus encore, certaines enzymes contenues dans un extrait de cellules sanguines détruisent l’ATP. Plus tard, Kalkar a montré que si nous ajoutons une enzyme à l’extrait, le ratio d’ATP augmente en présence d’oxygène.
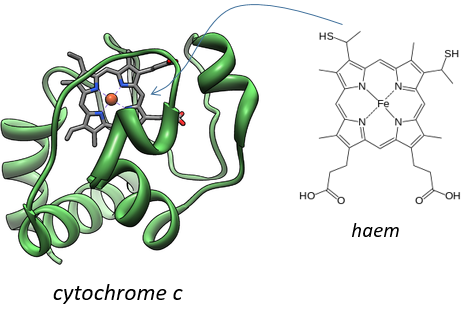
Keilin (1925) étudiait les moustiques responsables du paludisme. Avec un spectromicroscope, il a regardé les pattes d’un moustique et a vu qu’elles changeaient de couleur. Au repos les muscles s’oxydent mais quand ils sont excités les muscles consomment l’oxygène et sont donc moins oxydés. La couleur est donnée par le cytochrome, une molécule qui change de couleur en fonction de l’oxydation.
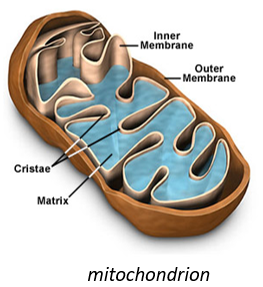
Cette molécule appartient à la mitochondrie. La mitochondrie est une sorte de bactérie hébergée par les eucaryotes.
Ils ont leur propre membrane, composée d’une membrane interne et d’une membrane externe poreuse. La matrice est à l’intérieur de la membrane interne et l’espace intermembranaire est également appelé cristae où la membrane est en saillie. De même que l’hémoglobine, le cytochrome est une protéine qui possède une hème dont le fer peut changer d’état d’oxydation. Cette propriété est utilisée dans la chaîne respiratoire. Le cytochrome appartient à la membrane interne de la mitochondrie le long de laquelle il peut se déplacer et il sépare la glycolyse du cycle de l’acide citrique. Le cycle de l’acide citrique se déroule dans la matrice de la mitochondrie tandis que la glycolyse se déroule à l’extérieur de la mitochondrie.
Chaîne respiratoire :
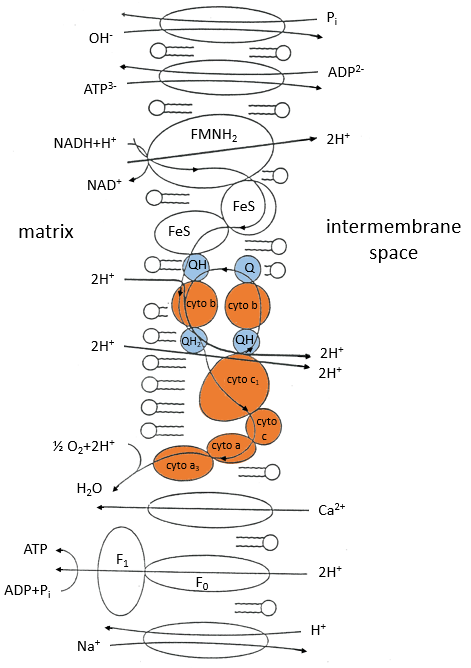
La chaîne respiratoire peut être résumée par la figure et le tableau suivants:
Dans la membrane interne nous trouvons 4 complexes – NADH-ubiquinone réductase, succinate-ubiquinone réductase, ubiquinol-cytochrome c réductase et cytochrome oxydase – qui font des réactions redox et transfèrent des électrons d’un côté de la membrane à l’autre (parfois des protons au lieu des électrons). Une réaction d’un côté de la membrane (matrice ou espace inter-membranaire) est toujours couplée à une réaction de l’autre côté de la membrane. Une réaction de réduction est couplée à une réduction de l’oxydation et vice-versa. Tout le phénomène implique des transferts d’électrons à l’intérieur de la membrane et des transferts de protons d’un côté de la membrane à l’autre. Notez que certains complexes appartiennent à la membrane mais ne font face qu’à l’un de ses côtés.
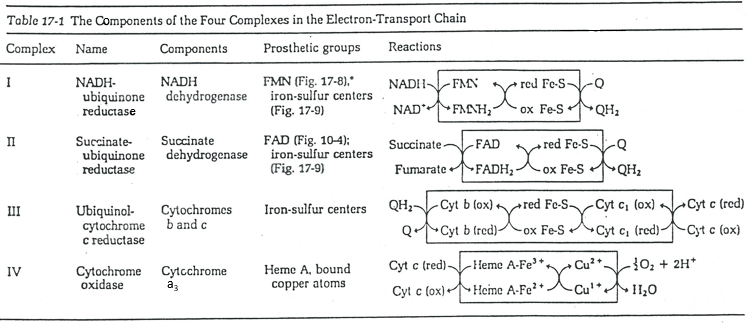
Q est l’ubiquinone, un cofacteur qui appartient à la membrane. Il interagit avec le cytochrome c dans une boucle d’oxydoréduction. On peut voir que l’oxygène est impliqué par le complexe IV. Pour reprendre la boucle, on peut écrire deux réactions d’oxydoréduction, l’une avec le NAD et l’autre avec le FAD.
Cependant O2 ne peut pas interagir directement avec FADH2 et NADH+H+ et cette boucle est donc nécessaire. Pour redox, l’énergie libre de Gibbs est :
Pour déterminer la différence de potentiel ΔE °, nous regardons les couples impliqués dans la réaction:
Pour FAD, nous avons 43.3 kcal/mol. Il y a un transfert de protons impliqué dans le processus mais il doit y avoir un équilibre entre les concentrations de charge à l’intérieur de la cellule et à l’extérieur de la cellule. Les protons peuvent sortir de la matrice de la mitochondrie à travers des complexes protéiques qui génèrent de l’ATP à partir du flux de protons (en bas de la figure) La protéine F1-ATPase est composée de deux parties, F0 dans la membrane et F1 dans la matrice de la mitochondrie. F0 pompe les protons de l’espace intermembranaire vers la matrice. F1 reçoit l’énergie du transport et transforme l’ADP en ATP. Ces espèces sont chargées négativement et nécessitent un transport à travers la membrane (haut de la figure). Un ADP ne peut entrer dans la matrice que si un ATP sort de la matrice. Les phosphates inorganiques Pi sont également transportés à travers la membrane. L’énergie pour former l’ATP provient du gradient de pH. Il génère une force motrice protonique.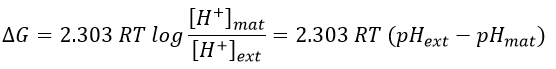
Où les indices mat et ext sont respectivement matrice et son extérieur (l’espace intermembrane). Le gradient de pH génère une différence de potentiel électrique ΔV.
En combinant les deux effets, nous avons
En divisant cette expression par nF, on obtient l’expression d’une variation de l’énergie libre Δp associée au transfert d’une mole de protons (en volt).
Le coefficient 2,303RT / nF du gradient de pH a une valeur de 59 mV à 25 ° C.
On peut mesurer le pH et la différence de potentiel: ΔV = 0.14V et ΔpH = -1.4.
Cela correspond à une variation d’énergie libre égale à :
Pour former une mole d’ATP, nous avons besoin de 7,3 kcal. Dans la chaîne respiratoire, il y a 4 complexes qui oxydent le NADH et le FAD. Ils forment respectivement l’équivalent de 11 et 8 protons par boucle.
Nous pouvons écrire une équation globale de la « combustion » d’un pyruvate au cours du cycle de l’acide citrique et de la chaîne respiratoire: Pour résumer, l’oxydation d’un NADH génère ~ 3 ATP et l’oxydation de FAD génère ~ 2ATP.
Les 15 ATP viennent de
4 NADH (un avant le cycle de l’acide citrique et 3 pendant le cycle) : 12ATP,
de 1 FADH2 : 2ATP
et à partir de 1 GTP :1 ATP.
Pour former un pyruvate, la glycolyse forme 2 ATP et utilise 2 NAD qui sont réduits en NADH + H +.
Donc en considérant 3 ATP par NADH, cela correspond à la production de 8 ATP. Ajouté au 15 ATP de chaque pyruvate (x2), on obtient 38ATP par glucose. Par rapport à la combustion du glucose (ΔG ° ‘= – 686kcal / mol), il représente environ 40% de l’énergie potentielle (38×7.3kcal / mol = 277kcal / mol).
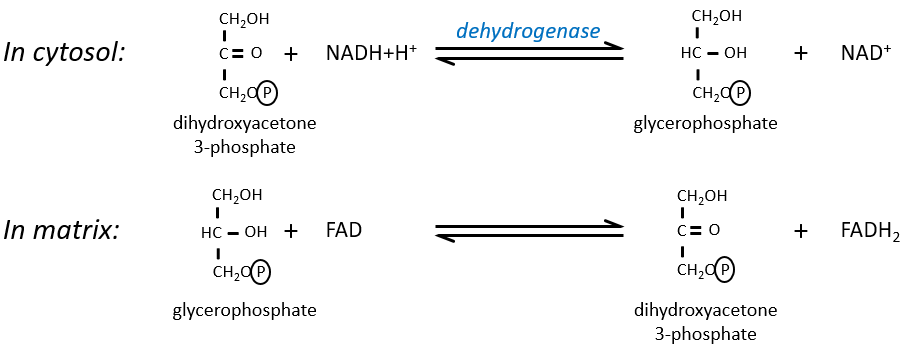
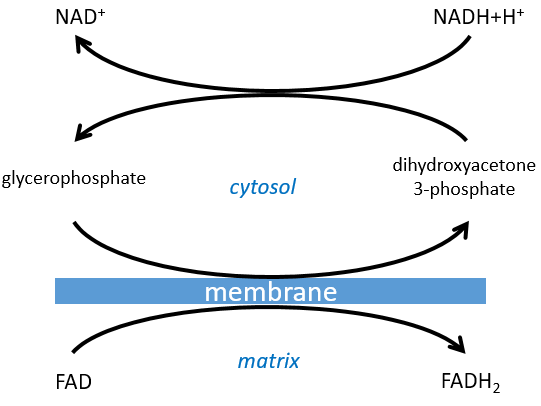
Le NAD impliqué dans la glycolyse et qui produit un NADH n’est pas au même endroit (cytosol) que le NADH requis dans la respiration cellulaire (matrice de la mitochondrie). Le NADH ne peut entrer librement dans la mitochondrie parce qu’il est chargé. Il existe un système de navette qui peut différer pour différentes cellules et qui va modifier le NADH pour permettre son passage à travers la membrane, puis le modifier à nouveau pour qu’il puisse y être utilisé. Dans le cerveau et dans les muscles, c’est une navette de glycophosphate que nous allons expliquer. La navette est fondamentalement composée de deux réactions: une dans le cytosol et une dans la matrice de la mitochondrie:
La navette peut être représentée comme comme ceci :
Si vous vous souvenez, la dihydroxyacétone-3P faisait partie de la glycolyse (rectangle rouge sur la figure suivante): c’est l’un des deux trioses phosphates produits à partir du fructose -1,6-diphosphate. Le fait que ce triose soit impliqué dans la navette ne diminue pas significativement le rendement de la glycolyse: la cellule a besoin d’une quantité donnée de dihydroxyacétone pour la navette mais les molécules sont régénérées dans la matrice des mitochondries et peuvent alors retourner au cytosol. Donc, ils doivent juste être produits une fois. Le reste de la production est transformé en glycéraldéhyde 3P pour la glycolyse.
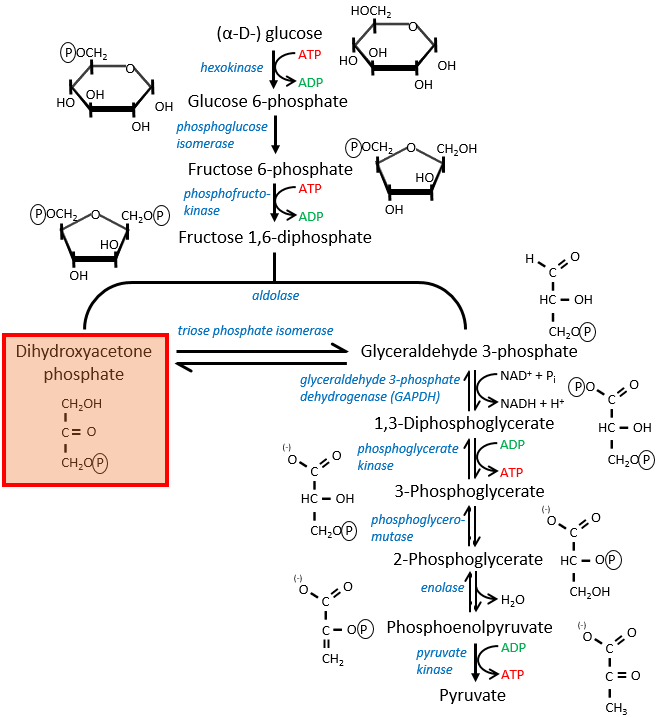
Le FADH2 est oxydé pendant la respiration et la dihydroxyacétone peut revenir au cytosol. La navette a un faible coût: elle oxyde un NADH en NAD dans le cytosol alors que la réaction dans la matrice implique FAD / FADH2. En terme d’énergie, il représente un ATP utilisé car tous les processus ne se déroulent pas au même endroit.
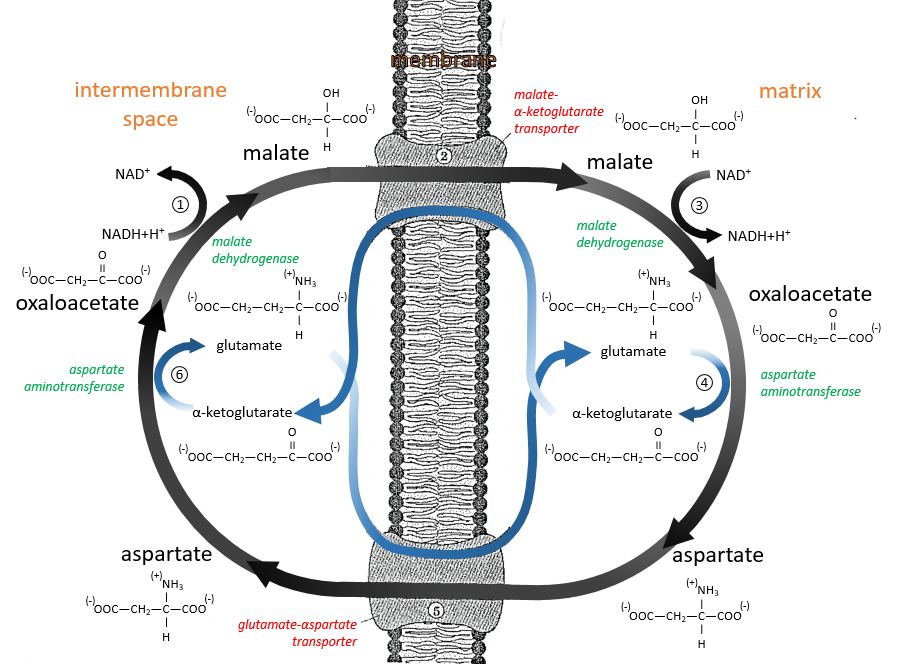
La navette malate-aspartate :
Les mêmes cofacteurs (NADH+H+/NAD+) sont utilisés donc le rendement ne change pas avec cette navette (ATP 38). Le mécanisme est basé sur le pouvoir réducteur de l’oxaloacétate.
Réduit en malate (1), il est transporté dans la matrice de la mitochondrie (2) à travers le transporteur malate-α-cétoglutarate si un α-cétoglutarate est disponible pour effectuer le déplacement dans la direction opposée. La réaction inverse, l’oxydation du malate en oxaloacétate est faite dans la matrice (3). Pourtant, l’oxaloacétate ne peut pas sortir de la membrane. Pour ce faire, il est transformé en un acide aminé, l’aspartate, par une réaction de transamination (4):
Il est fait ici par l’aspartate transaminase avec l’utilisation du glutamate comme acide aminé. En conséquence, l’oxaloacétate est transformé en aspartate qui peut se déplacer à travers la membrane à travers un transporteur nécessitant le passage dans la direction opposée d’un glutamate (5). Dans le cytosol, il est retourné dans l’oxaloacétate avec exactement la même réaction (6) que de l’autre côté de la membrane.