Introduction
Permet la culture à grande échelle dans le but de produire divers molécules biologiques
Cependant la culture in vitro ne permet pas :
– la prolifération et la différenciation normale des cellules
– la reproduction de l’architecture tissulaire de l’organe
– les interactions cellules-cellules et cellules-matrice extracellulaire
I Lignées cellulaires
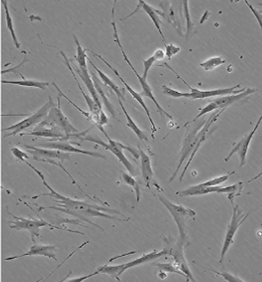
La culture de cellules primaires
Il s’agit de cellules issues du tissu d’un animal qui peuvent être dérivées de tissus normaux, d’embryons, de tumeurs. Ils peuvent provenir :
– d’un fragment de tissu (mélange de plusieurs types cellulaires)
– de cellules individualisées (désagrégation d’un fragment de tissu)
Méthodes de désagrégation du tissu :
– forces mécaniques : homogénéisation, sonication légère
– méthode enzymatique : trypsine, collagénase
– agents chélateurs : EDTA, EGTA
Enfin il faudra procéder au comptage des cellules et ensemencement (105-106 cellules / cm3).
La culture de cellules finies
Ce sont des cellules qui vont se diviser pendant un nombre donné de passage puis entrer en senescence (=ralentissement progressif de la prolifération cellulaire, puis la mort) et se diviser de moins en moins.
A noter que les lignées cellulaire finies provenant d’embryons vont se diviser plus que celles originaires d’un tissu adulte.
Exemple : W138 (fibroblastes humains) et MRC5 (tissu pulmonaire d’un fœtus)
La culture de cellules continues
Il s’agit ici de lignées cellulaires qui ont été transformées et immortalisées.
- La transformation
consiste en l’ introduction de changements dans une cellule conduisant à un phénotype de croissance et à l’immortalisation.
- Agents transformant :
– carcinogènes chimiques
– radiations ionisantes
– infection virale
II Origine des lignées cellulaires
Organes à partir desquels les cellules peuvent être cultivées :
– système tégumentaire et muscle (mélanocytes, kératinocytes, muscles, cellules graisseuses)
– tractus gastro-intestinal : épithéliums salivaire et intestinal, pancréas, foie
– système respiratoire : poumon, alvéole, bronche
– système reproducteur : utérus, cellules de Sertoli
– système endocrine : thyroïde, pancréas
– système ostéo-articulaire : chondrocytes, ostéoblastes
– système nerveux : cellules gliales, ganglions
– système cardiovasculaire : myocytes, cellules endothéliales
– système hématopoïétique : progéniteurs, macrophages, lymphocytes
Ces lignées cellulaires proviennent principalement de l’homme et de la souris.
Il existe actuellement deux collections majeures de lignées cellulaires :
– ATCC : American Type Culture Collection
– ECACC : European Collection of Animal Cell Cultures
III Les types de lignées cellulaires
Cellules non adhérentes
- Les lignées lymphoblastoides
– qui dérivent de lymphocytes
– et peuvent se diviser à l’infini par transformation
- Les hybridomes
qui sont issues de la fusion d’un lymphocyte B avec une cellule de myélome
Cellules adhérentes
- Les cellules épithéliales ou épithéliales-like dérivent d’un épithélium
- Les fibroblastes ou cellules fibroblastes-like constituent le tissu conjonctif sous forme de fuseau
IV Les conditions nécessaires à la croissance
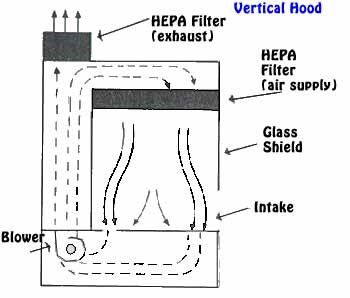
– Stérilité :
Le matériel nécessaire à la culture doit être stérilisé ainsi que tout les éléments utilisés dans la salle de culture. Travail sous hotte a flux laminaire équipé d’un filtre HEPA.
– la température : en règle générale, 37°C
– la pression osmotique : 260 – 320 mOsm/kg
– le pH : environ 7,4. Indicateur = rouge de phénol (devient jaune en milieu acide). Certains tampon vont maintenir le pH (HEPES)
– les ions inorganiques (sels minéraux, exple : Ca2+ pour attachement et signalisation)
– les métabolites (acides aminés)
– les hormones et facteurs de croissance
– une surface solide
Les supports de culture sont en plastiques :
-Polystyrène stérilisé par irradiation-gamma
-Polytétrafluoroéthylène (hydrophile ou hydrophobe selon les cas)
Possibilité de coater ces supports avec un agent tel que le collagène, la fibronectine, le poly-L-arginine, la gélatine ou encore le DEAE-dextran qui va faciliter la croissance cellulaire.
V Les milieux de culture
Milieux de base
| Composant | Fonction |
| Solution saline | Maintien du pH, de la pression osmotique, du potentiel de membrane, contient des cofacteurs pour certaines enzymes |
| Tampon (HEPES) | Compensation de la production de CO1 et lactate |
| Carbohydrates (Glucose) | Source d’énergie |
| Acides aminés | Aa essentiels pas produits par la celluleAa non-essentiels peuvent être perdu par la cellules dans le milieu |
| Vitamines | Précurseurs de cofacteurs |
| Hormones/Facteurs de Croissance (insuline, EGF, FGF) | Stimulation de la prolifération et de la différenciation |
| Protéines (albumine) | Transport des hormones, vitamines, lipides |
| Acides gras/Lipides | Biosynthèse de la membrane |
| Autres | Cofacteurs d’enzymes |
| Composant | Fonction |
| Solution saline | Maintien du pH, de la pression osmotique, du potentiel de membrane, contient des cofacteurs pour certaines enzymes |
| Tampon (HEPES) | Compensation de la production de CO1 et lactate |
| Carbohydrates (Glucose) | Source d’énergie |
| Acides aminés | Aa essentiels pas produits par la celluleAa non-essentiels peuvent être perdu par la cellules dans le milieu |
| Vitamines | Précurseurs de cofacteurs |
| Hormones/Facteurs de Croissance (insuline, EGF, FGF) | Stimulation de la prolifération et de la différenciation |
| Protéines (albumine) | Transport des hormones, vitamines, lipides |
| Acides gras/Lipides | Biosynthèse de la membrane |
| Autres | Cofacteurs d’enzymes |
Exemples de milieux de base :
MEM (Modified Eagle’s Media), DMEM (Dubelcco-MEM), RPMI (Roswell Park Memorial Institute …)
Le sérum
Le sérum est la partie du liquide sanguin débarrassé des protéines de coagulation et des globules rouges. De façon générale, les milieux de culture contiennent 5-20% de sérum.
Le sérum le plus utilisé est le sérum de veau fœtal (SVF) car il contient des facteurs de croissance embryonnaires.
| Composant | Fonction |
| Facteurs de croissance | Stimulation de la prolifération et de la différenciation |
| Albumine | Transport des hormones, vitamines, lipides |
| Transferrine | Transport des ions |
| Anti-protéases (antitrypsine) | Prévention des dommages protéolytiques sur la cellules |
| Facteurs d’attachement (fibronectine, laminine) | Permet l’adhésion des cellules au substrat |
Le sérum est décomplémenté par chauffage à 56°C pendant 30 min. Ce qui permet d’inactiver les protéines du complément qui pourraient nuire aux cellules. En effet le sérum peut-être une source majeure de contamination (virus, bactéries).
Les antibiotiques
Afin de prévenir d’éventuelles contaminations.
| Antibiotiques | Utilisation |
| Ampicilline | Bactéries Gram+ et Gram- |
| Gentamicine | Bactéries Gram+ et Gram-, mycoplasmes |
| Streptomycine | Bactéries Gram+ et Gram- |
| Pénicilline | Bactéries Gram+ |
| Nystatine | Champignons et levures |