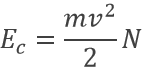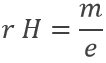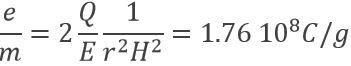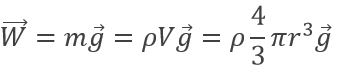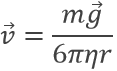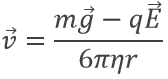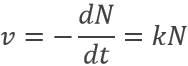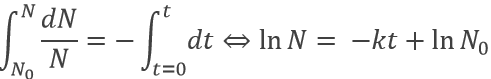Thérie atomique
A la fin du XIX il était connu que les éléments étaient faits d’atomes, incassables et différents pour chaque élément. Les masses des atomes étaient connues pour plusieurs éléments, mais leur composition était encore un mystère.
Michaël Faraday a découvert que les atomes étaient en fait composés d’espèces chargées, même s’ils sont électriquement neutres. Sa découverte est le résultat d’une expérience dans laquelle un courant passe à travers des électrodes d’argent irrécupérables dans une solution contenant de l’argent (AgNO3). Quand le courant passe, la masse de l’électrode augmente de manière significative. Les ions d’argent dans les solutions réagissent avec les électrons du courant pour former une collection solide d’argent sur l’électrode.
Cette réaction a montré que les atomes contiennent des éléments positivement chargés ainsi que des espèces négativement chargées pour neutraliser la charge de l’atome.
Joseph John Thomson a prouvé l’existence d’électrons en 1897 au cours de ses travaux sur les tubes cathodiques. Ces tubes contiennent seulement le vide, une cathode et une anode. Si la cathode est chauffée, un courant est détecté entre les électrodes. Le chauffage détermine l’énergie cinétique transmise à l’atome de la cathode :
Bien que la charge e- des électrons est donnée par le courant :
L’application d’un champ magnétique H sur le tube cathodique, si seulement une petite fente permettait les électrons pour atteindre l’anode, aucun courant a été observé : le faisceau d’électrons se déviait de sa trajectoire normale selon le rapport masse / charge. Les parois de la fente ont été couvertes par ZnS une espèce fluorescente pour détecter la déviation du faisceau (rayon de déviation r) :
En conséquence le rapport e / m d’un électron a été déterminé :
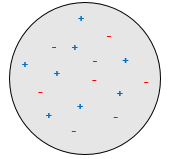
JJ Thompson a imaginé un modèle sphérique pour l’atome dans lequel une mer d’espèces chargées se déplacent (le modèle de plum-pudding).
La charge de l’électron a été déterminée par Robert Andrews Millikan. Il a envoyé un faisseau de RX sur des gouttelettes d’huile entre deux électrodes horizontales. Les gouttelettes chargées sont soumises à plusieurs forces : leur propre poids, la force électrostatique et le frottement de l’air (l’air possède une viscosité donnée).
Le poids d’une gouttelette est donnée par :
m étant la masse d’une goutte donnée qui est égale à sa densité multipliée par son volume et g est la gravité. La force électrostatique est donnée par :
où E est le champ électrique et q est la charge. Le frottement est donné par :
où η est la viscosité de l’air et v est la vitesse de la gouttelette. En l’absence de champ électrique, la goutte devrait tomber à une vitesse :
Résultant des équations de W et FR. Toutefois, dans le champ électrique E, la vitesse d’une gouttelette est affectée :
Sauf q tous les termes de la droite de l’équation sont connus et la vitesse des gouttelettes a été déterminée expérimentalement : une gouttelette est observée à travers un microscope pour mesurer le temps qu’il faut pour parcourir une distance donnée.
Le résultat de l’expérience était que la charge q était toujours un multiple de
1.602 10-19C, quelques gouttelettes étant chargées plusieurs fois. La masse d’un électron pourrait ainsi être déterminée : me=9.11 10-31kg.
Malgré son expérience brillante le modèle plum-pudding de JJ Thompson n’était pas correcte et a été réfutée par Ernest Rutherford (qui a réellement été un de ses élèves) le pionnier de la chimie nucléaire. Rutherford a étudié l’émission de particules α de l’uranium. Les particules α sont l’équivalent du noyau des atomes d’hélium : 2 neutrons et 2 protons: He2+.
Les particules α ont été envoyées vers une mince feuille d’or. Compte tenu du modèle de Thompson la totalité du rayonnement aurait dû passer à travers la feuille d’or. Il y a eu 99% de passage et il n’a pas été due à une erreur expérimentale. Certaines des particules α ont été déviées dans toutes les directions. Il a conclu que le 1% déviait sur une agrégation solide avec une charge positive intense qui composait la majorité de la masse de l’élément. Le reste du volume d’un atome est rempli par l’espace vide et un nuage d’électrons. La taille d’un atome est d’environ 1 angström (1Å)=10-10m et la taille du noyau est 10-15m.
Rutherford a également été le premier à transformer un élément en un autre. Il l’a fait en bombardant l’azote pur par des particules α et il a obtenu de l’oxygène et des noyaux d’hydrogène (les protons n’étaient pas encore connus). Il a supposé que les noyaux d’hydrogène faisaient partie du noyau solide des atomes. A partir de là les atomes n’étaient plus incassables.
Plus tard Rutherford a théorisé l’existence de neutrons pour maintenir le noyau chargé positivement en une seule pièce, en réduisant la répulsion des protons et en donnant une énergie de cohésion au noyau. Le plus gros de l’atome, les neutrons sont nécessaires (en proportion avec les protons).
Cette énergie de cohésion est en fait énorme. Par exemple le noyau de l’oxygène est formé de 8 neutrons et 8 protons mais la masse de l’atome d’oxygène est inférieure à l’addition de la masse des protons et des neutrons séparés :
La masse d’un atome d’oxygène est 2.65535.10-23g. La différence est d’environ 2.269.10-25g par atome. Comme E=mc2, nous obtenons pour une mole une énergie de cohésion de 1.23.1013J/mol d’oxygène. A titre de comparaison une réaction chimique typique est~105J/mol. Il n’est donc pas surprenant que les réactions nucléaires produisent beaucoup d’énergie.
Réactions nucléaires
La chimie nucléaire est un domaine très spécifique de la chimie. C’est un domaine où la règle de Lavoisier ne marche pas : les éléments ne sont pas conservés et la masse peut être convertie en énergie. Pourtant plusieurs types de réactions peuvent être triés. Mais d’abord nous allons jeter un oeil à la façon d’écrire les isotopes. L’isotope 238 de l’uranium est écrit :
U est le symbole de l’élément, la masse est écrite en haut à gauche de l’élément et son numéro atomique est écrit en bas à gauche.
1) La production des particules α
Rappelez-vous qu’un
La désintégration de l’uranium 238 est un exemple de réaction produisant des particules α :
La valeur totale du nombre supérieur est conservée au cours de la réaction. La même chose est vraie pour le nombre inférieur. Le produit γ est un rayonnement gamma, produit par désintégrations radioactives, car le noyau formé est généralement dans un état excité et quand il revient à son état de base l’énergie est libérée sous la forme d’un rayonnement électromagnétique.
2) La production de particules β
Les particules β sont des petites espèces chargées émises lors de certaines réactions nucléaires. Le thorium 234 obtenu précédemment peut produire ce genre de particules :
La masse de l’élément n’a pas changé au cours de cette réaction. Cependant l’élément a été modifié de thorium à Protactinium, un neutron est devenu un proton. La particule β produite au cours de cette réaction est un électron rejeté du neutron pour devenir un proton.
Un antineutrino est également généré. Un noyau a donné une rotation en fonction de sa charge : elle tourne sur elle-même dans une direction donnée. Les électrons ont également un spin.
Au cours de la réaction nucléaire en haut, la charge du noyau a changé et un antineutrino est libéré pour obtenir la bonne rotation.
Une seconde particule β peut être obtenue, par exemple, lors de la désintégration de sodium 22 :
La particule β est un électron mais pas un positron. Un neutrino est également obtenu lors de cette réaction. Les neutrinos et antineutrinos sont des rayonnements qui peuvent passer à travers tout.
Les électrons et les positrons peuvent se neutraliser pour produire un rayonnement gamma :
Fission :
La fission est faite en bombardant un isotope avec des neutrons. Dans les centrales nucléaires, la fission se fait sur l’uranium 235 :
Il ya plus de neutrons produits par la réaction que nécessaire pour le lancer. Cette réaction peut donc recommencer tant qu’il est de l’uranium 235 dans le réacteur. Un autre moyen d’arrêter la réaction est de piéger les neutrons avec un autre isotope.
Fusion
La fusion se fait par la fusion de deux isotopes. Par exemple deux isotopes d’ hydrogène peuvent produire de l’hélium :
![]()
Une autre façon d’obtenir l’hélium est de bombarder l’hydrogène avec des électrons :
Il est également une réaction de fusion.
Les éléments utilisés dans la fusion et dans la fission sont différents. L’énergie de la cohésion est différente pour chaque élément et on peut observer un maximum d’énergie de la cohésion/nucléon (proton + neutrons) pour 56Fe.
La fusion est effectuée sur des éléments de masse inférieure à 56Fe. Les atomes gagnent de l’énergie de la cohésion lors de la fusion. D’un autre côté des éléments de masse élevée perdent de l’énergie de cohésion et de la masse à partir de 56Fe.
Temps de demi-vie
Les éléments radioactifs ne restent pas toujours actif. La radioactivité diminue avec le temps proportionnellement au nombre des particules :
où v est la vitesse de décomposition, N le nombre de particules radioactives et k une constante de vitesse en fonction de l’isotope.
Comme elle dépend du nombre de particules la vitesse diminue au fil du temps. Nous pouvons intégrer l’équation de la vitesse :
Le temps de demi-vie est le temps nécessaire pour diminuer la population d’un élément radioactif de moitié :
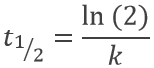 ce temps ne dépendant que de l’isotope et ne dépend pas de la population de l’isotope.
ce temps ne dépendant que de l’isotope et ne dépend pas de la population de l’isotope.