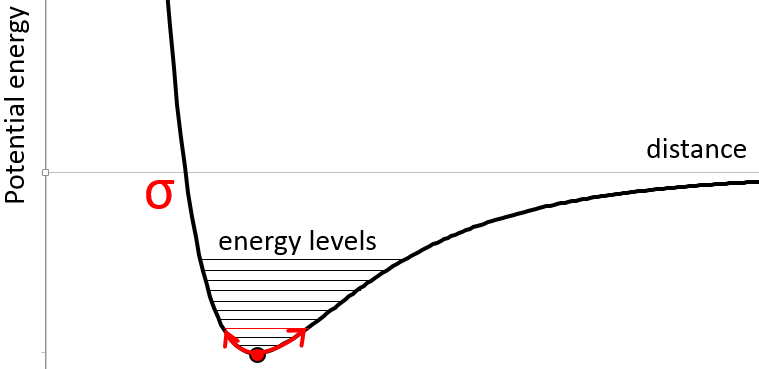
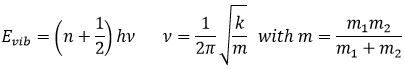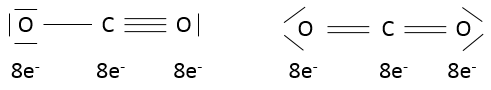Les atomes font des liaisons parce qu’ils obtiennent plus de stabilité. Une preuve en est que pour briser une liaison nous devons donner de l’énergie à la molécule. Les atomes dans une molécule sont à une distance donnée et oscillent légèrement de cette position en fonction de l’énergie qu’ils reçoivent.
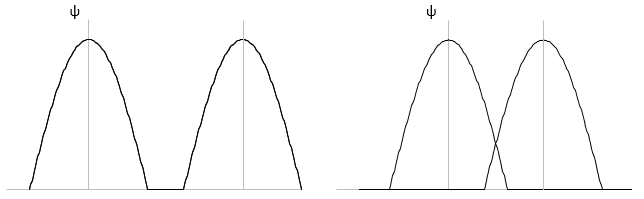
Les atomes ne peuvent pas osciller à une fréquence quelconque. Il y a des niveaux autorisés d’énergie dans lesquels l’atome peut être placé :
Même à n = 0, l’état fondamental, les atomes oscillent à une fréquence donnée.
Il est difficile d’approcher plus les atomes les uns des autres mais il faut aussi de l’énergie pour les éloigner. L’énergie de dissociation est l’énergie nécessaire pour séparer deux atomes à une distance « infini ».
Pour former une liaison, les nuages d’électrons autour des noyaux se concentrent entre les deux noyaux pour protéger leur charge et diminuer la répulsion entre eux. La répartition des électrons diffère selon le type de liaison. Nouvelles orbitales, orbitales moléculaires sont formées à partir des orbitales atomiques pour lier deux atomes :
Seule la dernière couche d’électrons, les électrons de valence, est prise en compte pour les orbitales moléculaires : les couches internes sont trop éloignés pour interagir :
4 types de liaisons existent: covalente, ionique, métallique et liaison coordinative (ou des ponts d’hydrogène). Nous allons développer les deux premiers types de liaison ici :
Liaisons covalentes :
Une telle liaison est faite entre les atomes de même électronégativité (ou presque). Chaque atome met un électron en commun pour faire une liaison covalente. Les électrons dans la liaison sont partagés à parts égales le long de la liaison.
Liaisons ioniques :
Une telle liaison est faite entre les atomes d’électronégativité différente. Dans une liaison ionique les électrons ne sont pas partagés équitablement. L’un est l’atome donneur d’électrons et l’autre est l’accepteur d’électrons. L’accepteur est plus électronégatif que le donneur.
Comme les électrons ne sont pas partagés de manière égale il existe un gradient de la charge le long de la liaison. Nous disons qu’il y a un moment dipolaire.
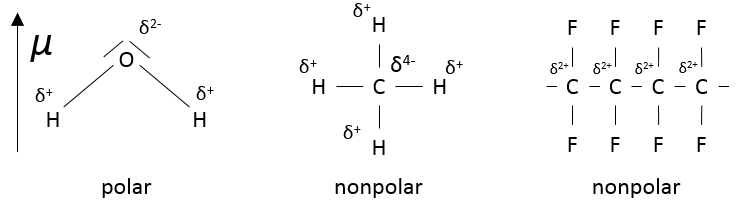
Polarité :
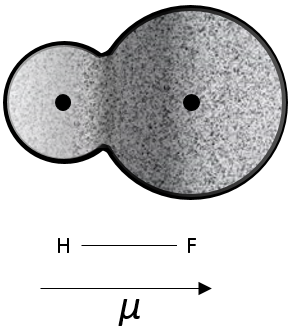
H et F ont des électronégativités différentes (2,1 et 4 respectivement). La plupart des électrons de la liaison sont donc plus proche de l’atome de fluor que de l’atome de l’hydrogène.
Le moment dipolaire mu de cette liaison peut être défini comme
Par définition, le moment dipolaire va de la charge positive à la négative. Si les charges ont été complètement séparées, ce moment devrait être :
D signifie Debye et est égal à 3.336Cm.
La valeur obtenue expérimentalement est 1.83D. Cela signifie que l’hydrogène ne donne pas totalement son électron au fluor. Le caractère ionique de la liaison est donnée par
Et si cette valeur est supérieure à 50%, nous considérons que la liaison est une liaison ionique.
Le fluor a la plus forte électronégativité mais n’a pas une polarité suffisamment importante pour avoir une liaison ionique avec l’hydrogène (41,6% seulement). La raison est que les deux ( H et F) ont un très petit rayon et que la longueur de la liaison est donc faible et la liaison est forte c’est la raison pour laquelle HF est un acide faible tandis que les autres acides halogènes sont des acides forts : la charge négative est plus stabilisé sur Cl-, Br- et I- que sur F-.
Notez qu’une molécule qui a des liaisons polaires n’est pas automatiquement polaire, CH4 est non polaire. Le polyfluorocarbone (CF2)n est aussi non polaire :
Les molécules polaires sont solubles dans des solvants polaires et les molécules non polaires sont solubles dans les solvants non polaires. Sur les vestes les molécules non polaires sont greffées pour que la pluie ne pénètre pas la veste mais puisse rouler sur elle. Sur une surface non polaire, l’eau ne se propage pas mais restreint sa surface au minimum, formant ainsi une sphère.
Règle de l’octet et la charge formelle :
Grâce à la liaison les atomes essayent d’avoir 8 électrons de valence la configuration électronique des gaz nobles. Par exemple CaCl n’est pas une molécule correcte. Ca a 2 électrons de valence et Cl en a 7. Pour lier Ca donne un électron à Cl. Cl atteint l’octet mais Ca a toujours un électron de valence à perdre. La formule correcte est CaCl2 : Ca donne un électron à chacun des deux Cl pour atteindre la structure électronique d’Argon (gaz noble).
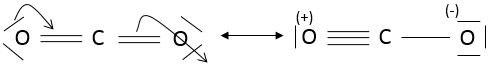
Dans CO2 , les liaisons sont covalentes et les électrons sont partagés entre C et O. CO2 pourrait avoir deux structures :
On peut voir que les oxygènes de la molécule de la gauche ne sont pas équivalentes. Dans une molécule la distribution électronique doit être la plus homogène possible. Chaque atome a une charge formelle (FC)
Analisons le FC de chaque atome :

Dans la molécule de la droite les atomes n’ont pas de charges formelles et cette molécule est donc plus stable que la molécule de la gauche où des charges sont séparées. En fait la première molécule est une forme de résonance (à savoir une structure ayant la même composition mais une répartition électronique différente) mais moins stables que la deuxième molécule:
La règle de l’octet fonctionne très bien pour les trois premières lignes du tableau de Mendeleïev. Après cela certaines orbitales nd vides peuvent être utilisées pour lier les atomes. Par exemple S peut se lier à 6 atomes de fluor (SF6).
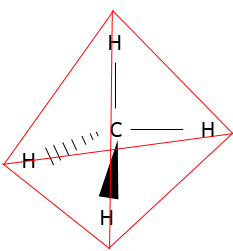
Maintenant est-ce que cette molécule est vraiment linéaire (comme nous l’écrivons)? Pour déterminer la structure spatiale d’une molécule nous devons considérer les orbitales atomiques de chaque atome et le fait que les liaisons sont répulsives entre elles (parce qu’elles sont chargées négativement). CO2 est donc linéaire ayant un angle de 180° entre les deux doubles liaisons pour réduire la répulsion entre elles. CH4 est un tétraèdre régulier, ayant un angle de 109° entre chaque liaison:
Le triangle noir est une liaison allant dans le sens du lecteur et les tirets représentent une liaison allant dans la direction opposée.
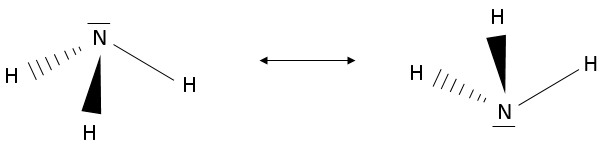
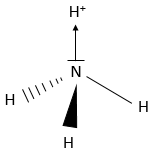
Les doublets libres prennent également l’espace dans une molécule. En fait ils prennent plus de place que la liaison normale : les électrons sont entassés près de l’atome. En conséquence H2O n’est pas linéaire mais est un tétraèdre. Cependant elle n’est pas un tétraèdre régulier car l’angle entre les paires libres (> 109°) est supérieure à la dist ance entre les liaisons (<109 °). NH3 est aussi tétraédrique , mais il a la particularité spécifique d’osciller rapidement entre les deux formes équivalentes :
Hybridation :
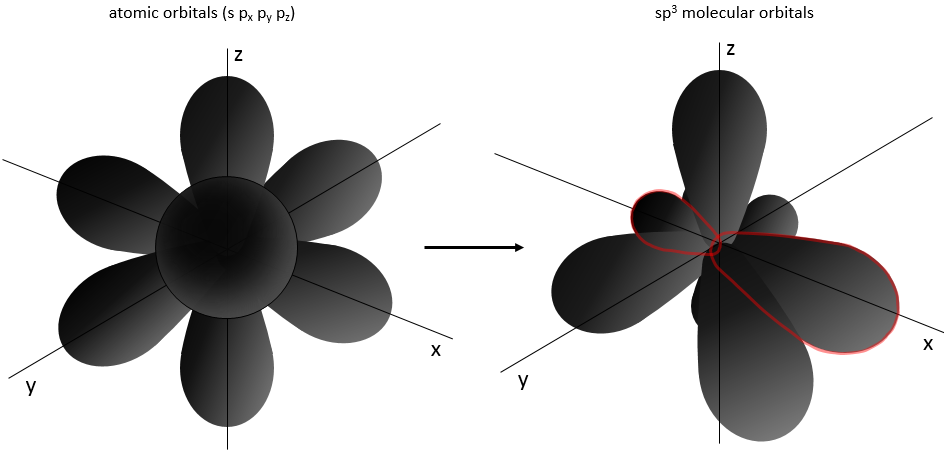
Nous avons vu plus tôt les formes d’orbitales atomiques (OA) et aucunes d’entre elles n’étaient tétraédriques. Les orbitales atomiques se mélangent pour former de nouvelles orbitales moléculaires (OM) qui sont utilisées pour se lier avec d’autres atomes, c’est le processus d’hybridation.
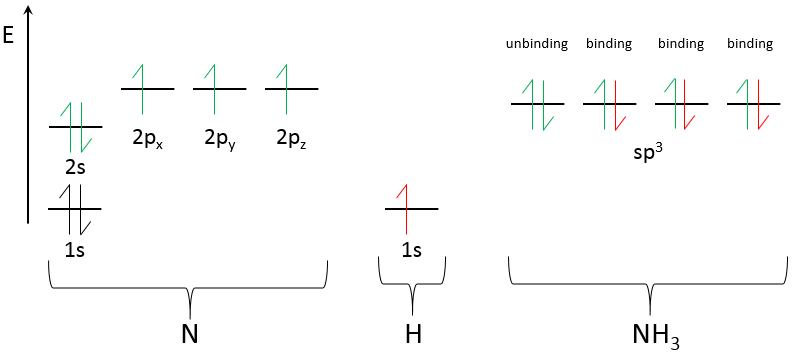
Une des orbitales moléculaires est indiquée en rouge pour plus de commodité. Ces orbitales hybrides sont le résultat de l’hybridation des orbitales atomiques s et p. Les orbitales ns et np ont des énergies différentes et se fondent dans les orbitales moléculaires sp d’énergies égales. Seule la dernière couche des orbitales (avec des exceptions) fusionne pour former un nouvel ensemble d’orbitales. Les orbitales intérieures ne sont pas modifiées comme indiqué pour le NH3 :
N dispose de 5 électrons de valence : 2 dans 2s et 3 dans 2p. Ils se fondent dans 4 orbitales sp3 d’énergie égale. L’exposant 3 sur p indique que 3 orbitales p ont été fusionnées avec une (pas indiqué comme exposant) orbitale s. Comme d’habitude les électrons sont placés sur toutes les orbitales avant d’être appariés. Une orbitale contient 2 électrons appariés déjà: il est la paire appariée. Les trois autres orbitales sp3 contienent 1 électron chacunes. L’hydrogène va apporter un électron supplémentaire sur ces orbitales pour se lier et former NH3.
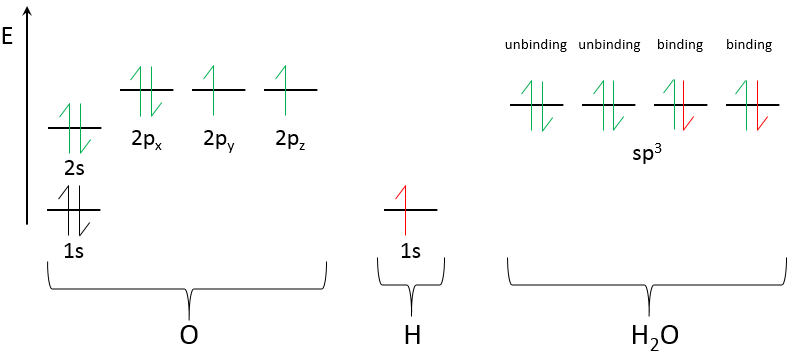
Nous pouvons faire la même chose pour H2O :
L’oxygène a un électron de plus que l’azote, il en résulte une seconde paire jumelée et seulement 2 liaisons d’hydrogène à O.
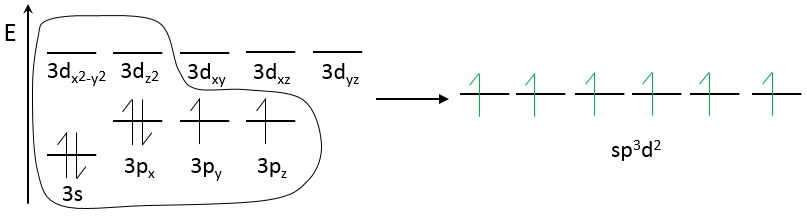
Pour SF6 deux orbitales 3d vides sont utilisés :
Quatre des six liaisons sont dans le même plan et les deux autres sont de chaque côté de ce plan. SF6 a donc une structure octaédrique.
les orbitales de liaison et d’antiliaison :
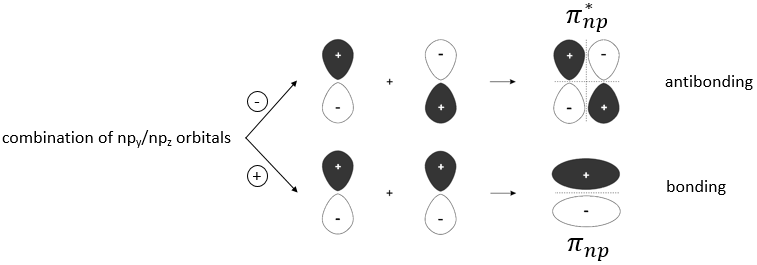
quand deux atomes se rapprochent les uns des autres leurs orbitales atomiques ultrapériphériques interagissent pour former des orbitales moléculaires. Nous avons vu précédemment les orbitales de liaison mais il n’ est pas la seule combinaison possible des orbitales qui peuvent avoir lieu. La combinaison peut être soit positive ou négative.
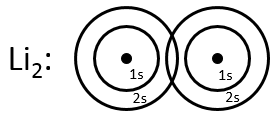
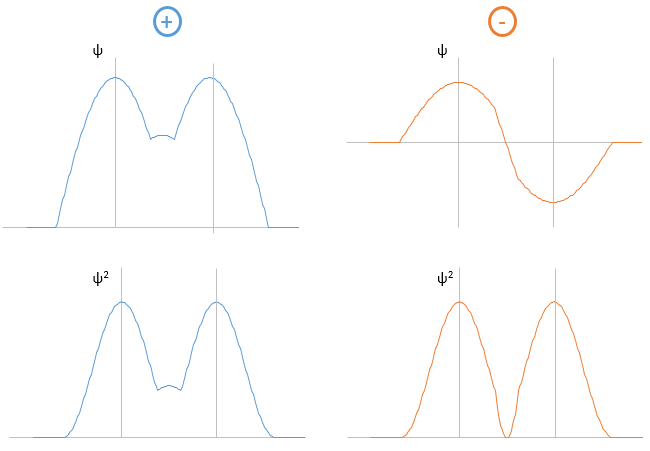
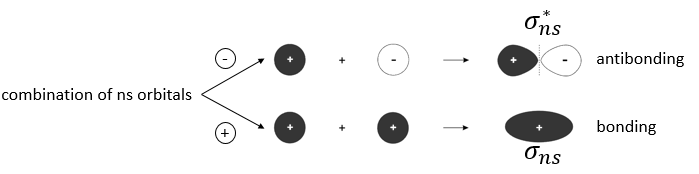
Li2 combine les orbitales 2s de chaque atome. Les combinaisons positives et négatives des fonctions d’onde donnent :
Si nous mettons cela à la puissance 2 nous obtenons la probabilité de présence des électrons. Dans le cas de la combinaison négative on peut voir qu’ entre les atomes il ya un point où la probabilité de trouver des électrons est nulle. Elle conduit à une orbitale antiliante. Dans le cas de la combinaison positive la probabilité de trouver des électrons entre les atomes est élevée partout. Elle conduit à une orbitale liante. Les orbitales liantes sont stables et conduisent à une liaison persistante. Les orbitales antiliantes sont instables et les liaisons ne sont pas faites. On note ces orbitales avec une *. Les orbitales moléculaires résultant des orbitales ns sont appelées sigma σ:
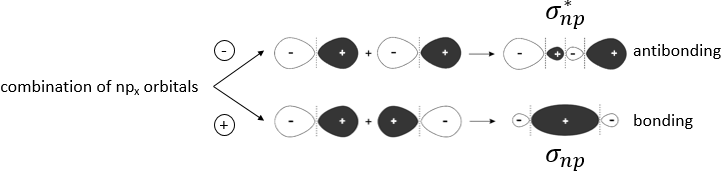
Le même genre de liaison et orbitales antiliantes existent pour les orbitales np, nd et nf. Les orbitales np dans le sens de la liaison forment un orbital sigma et les autres orbitales np sont responsables des liaisons doubles et triples et sont appelés liaisons pi :
Les orbitales moléculaires ont des énergies différentes et nous allons maintenant expliquer comment déterminer quelles orbitales sont utilisées et quelles autres ne le sont pas.
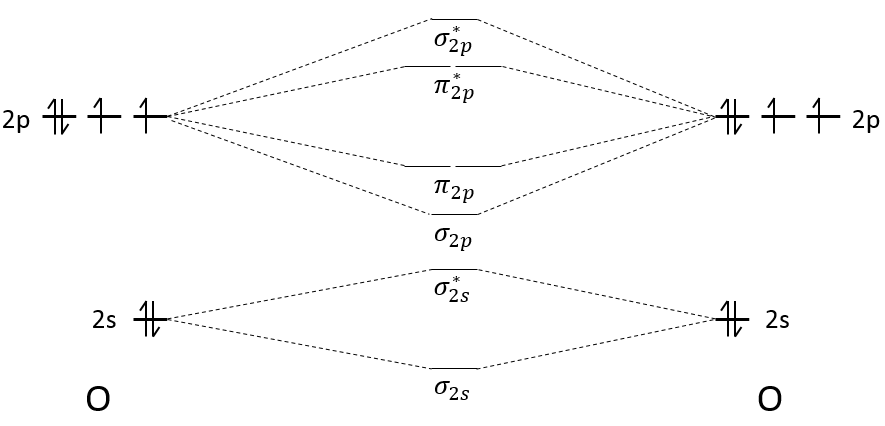
Les orbitales atomiques des deux atomes sont placées sur la gauche et sur la droite. Sur le milieu nous plaçons les orbitales moléculaires qui résultent des orbitales atomiques :
Chaque orbitale donne une orbitale moléculaire liante et une antiliante. Les orbitales moléculaires sont placées de bas en haut en allant de la moins énergique à la plus énergique. Pour Z <8, leMO π2p et σ2p sont inversés : la MO σ*1s et σ2s repoussent l’un contre l’autre. Pour déterminer l’énergie d’une orbitale moléculaire nous utilisons la combinaison linéaire des orbitales atomiques (LCAO). Cette méthode sera vue dans les cours de la deuxième ou troisième année. Cependant, comme il est une combinaison linéaire, l’énergie moyenne de l’orbitale moléculaire obtenu à partir d’orbitales atomiques est égal à l’énergie moyenne de ces orbitales atomiques. Par exemple l’énergie des orbitales moléculaires σ2s+ σ*2s est égale à l’énergie des orbitales atomiques 2s + 2s. C’est également le cas lorsque les orbitales atomiques ne possèdent pas la même énergie :
La deuxième étape consiste à distribuer les électrons sur la MO. Les électrons sont répartis de bas en haut et chaque orbitale moléculaire accepte deux électrons appariés.
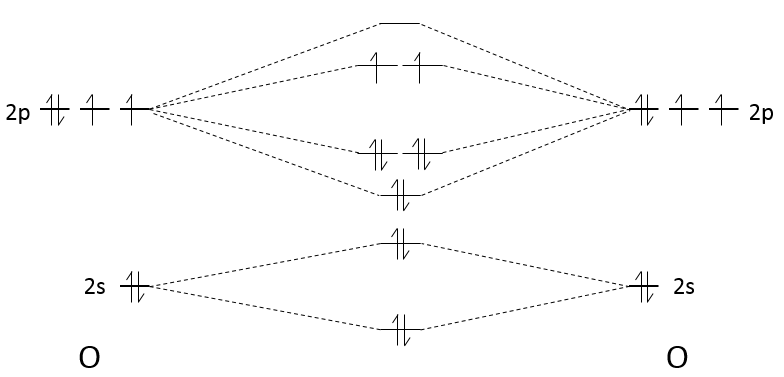
L’effet de la construction de ces orbitales moléculaires est que l’énergie des électrons a été réduit : seulement deux électrons ont une énergie supérieure à celle des orbitales 2p mais les 6 autres ont une plus petite énergie (sans compter les électrons des orbitales 2s). L’ordre de la liaison donne une bonne idée de la force de la liaison et est donné par :
L’ordre nous dit que la liaison entre les deux oxygènes est une double liaison. Lorsque l’ordre de liaison est grande cela signifie que la liaison est énergique et courte.
Magnétisme :
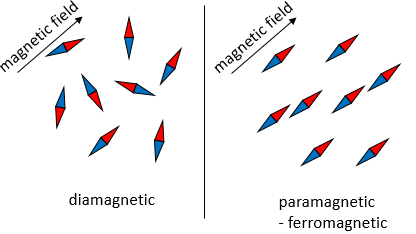
le magnétisme est la réaction d’une particule à un champ magnétique. En réaction à un champ magnétique une particule s’oriente contre le champ magnétique ou dans sa direction. Ce comportement dépend principalement de la structure électronique de la particule et de la température :
Diamagnetisme :
diamagnetisme est l’opposition de toute particule à un champ magnétique. Il apparaît dans tous les matériaux mais est très faible en ce qui concerne d’autres comportements magnétiques. En conséquence il est seulement visible dans les matériaux purement diamagnétiques. Pour cela un matériau diamagnétique a tous ses électrons appariés. Les spins opposés d’électrons appariés annulent le moment magnétique électronique intrinsèque : les électrons sont des espèces chargées tournant dans un sens (spin) autour du noyau et peuvent interagir avec un champ magnétique externe.
Des électrons non appariés alignés avec un champ magnétique orientent les particules dans la même direction que le champ magnétique. Toutefois, lorsque le champ extérieur est retiré, les particules ne conservent pas les propriétés magnétiques.
Ferromagnetism :
c’est la plus forte réaction à un champ magnétique et est la propriété des aimants. Quant au paramagnétisme les électrons non appariés alignent avec un champ magnétique mais il existe un effet supplémentaire pour les particules ferromagnétiques : les particules adjacentes alignées présentent une interaction magnétique dipôle-dipôle. Sous certaines conditions les orbitales de leurs électrons non appariés peuvent se chevaucher. En conséquence un effet similaire à l’exclusion de Pauli s’applique: il réduit l’énergie électrostatique des électrons quand leurs spins sont parallèles et non anti-parallèles. La différence d’énergie entre l’état parallèle et l’état anti-parallèle est appelée l’énergie d’échange et définit la force du ferromagnétisme d’une particule.
Couleur :
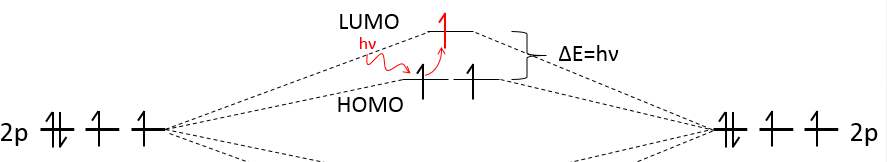
la couleur des composés vient directement de la différence d’énergie entre l’orbitale moléculaire (= HOMO) occupée la plus élevée et celle située juste au dessus (= BV, l’orbitale moléculaire inoccupée la plus basse). La molécule absorbe la lumière pour exciter un électron. Pour passer d’un niveau le photon doit avoir la même énergie que la différence d’énergie entre les niveaux. Cela signifie que seule la lumière d’une couleur donnée est absorbée. Parce que cette couleur est absorbée, nous ne la voyons pas mais nous voyons les couleurs qui ne sont pas absorbées par la molécule.
La fluorescence est la lumière émise lorsqu’un électron excité est dé-excité à un niveau intermédiaire à la place de son niveau fondamental. La couleur émise est donc différente de celle absorbée et le processus est très lent.
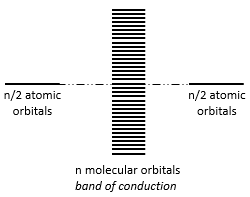
Liaisons métalliques :
dans un métal tous les atomes sont liés entre eux. Les orbitales moléculaires se fondent dans une bande de continuum de conduction. De ce fait les électrons sont partagés par tous les atomes dans le métal et peuvent se déplacer le long des électons du métal, c’est pourquoi les métaux conduisent l’électricité.
Liaisons coordinatives :
les liaisons coordinatives sont des liaisons faites quand un atome portant une (ou plusieurs) seule paire d’électrons utilise une paire pour se lier à un cation.
Les deux électrons d’une liaison coordinative proviennent à la fois d’un atome. La géométrie de la molécule ne change pas quand une liaison coordinative est faite et la liaison doit être à la position initiale de la paire libre.
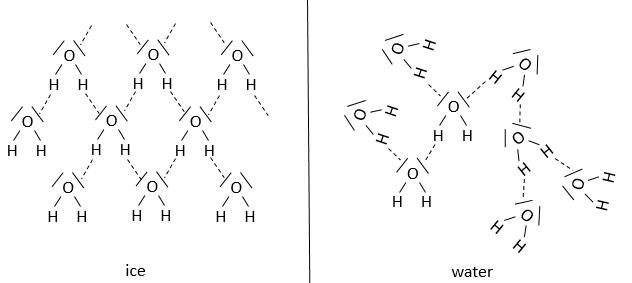
Dans les liaisons hydrogène le cation est un proton. Ces liaisons sont plus faibles que la liaison covalente normale mais peuvent avoir un rôle important dans la structure d’un composé :
Par exemple, la différence entre la glace et l’eau est la proportion et la disposition des liaisons hydrogènes. En effet les liaisons hydrogène travaillent en synergie pour renforcer la structure. Il existe une restriction de l’angle entre la liaison hydrogène et l’autre liaison hydrogène, qui dépend du composé. La présence et l’absence de liaison hydrogène a une grande responsabilité dans la structure et donc l’efficacité des protéines.
Le cation peut également être un métal de transition. Dans ce cas la molécule de liaison est appelée un ligand. Le ligand ciblera les orbitales nd vides du métal. La géométrie du composé résultant est tétraédrique ou octaédrique selon les orbitales moléculaires générées.
Les orbitales atomiques nd se divisent à deux niveaux d’énergie différents. Les orbitales d’énergie plus faible sont dxy, dxz et dyz pour la structure octaédrique et les orbitales dx2-y2 et dz2 ont une énergie plus élevée. C’est le contraire pour les structures tétraédriques.
La chimie de coordination est un domaine complexe de la chimie et il sera discuté en détail dans les cours de la deuxième année.