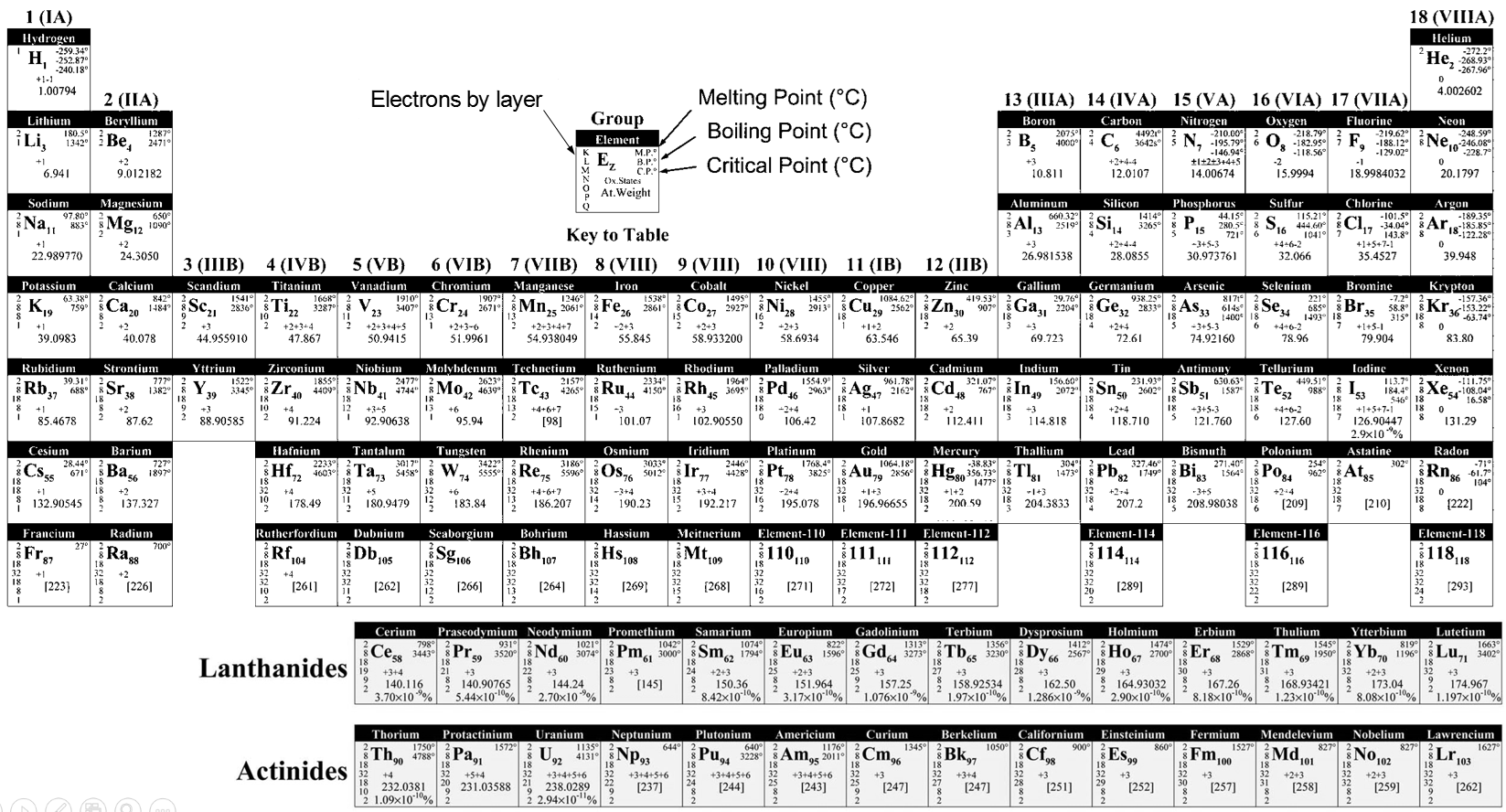
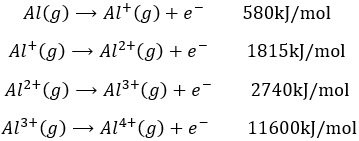Le tableau de Mendeleiev est aussi appelé la classification périodique des éléments. Plus qu’une simple liste des atomes existants, Mendeleïev a trié les éléments en fonction de leur oxydation / réduction par O / H
R20 R0 R302 RH4 RH3 RH2 RH R
Le R est l’élément. Les atomes du même niveau d’oxydation ont été triées en fonction de leur poids pour obtenir les différentes lignes. Certains trous étaient présents dans le tableau mais on a supposé que les éléments manquants ne sont pas encore découverts. Les scientifiques ont été en mesure de remplir le tableau périodique par la synthèse artificielle de ces éléments. Dans le tableau montré, ci-dessus, les éléments 110 à 118 sont théoriques.
On ne l’imaginait peut être pas au départ mais la détermination de ce tableau était une énorme amélioration pour les chimistes. Le tableau contient un nombre gigantesque d’informations pour chaque atome mais montre aussi certaines tendances périodiques.
Un cas :
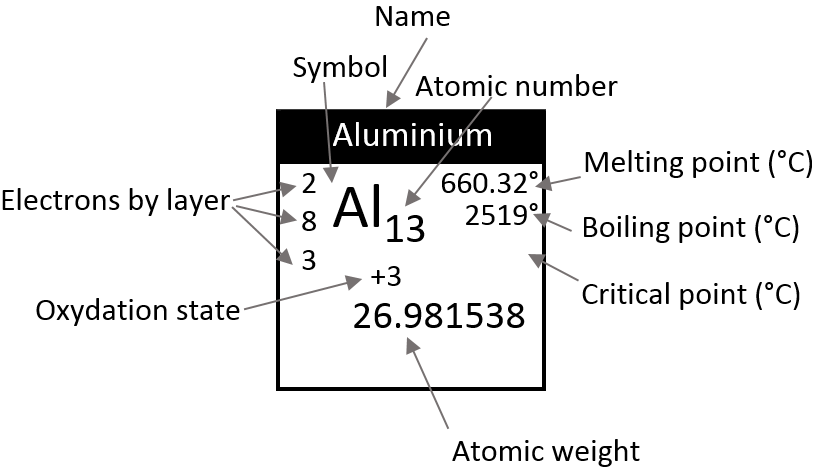
Il y a un grand nombre de modèles différents pour les tables périodiques. Certains d’entre eux ne montrent que le symbole, le nom, le numéro atomique (Z) et le poids de chaque élément, mais de nombreuses autres informations peuvent être affichées pour chaque élément. Voici un exemple pour l’aluminium.
Son symbole est Al, son numéro atomique est 13 et il a un poids de 26,981538 unités de masse atomique (ce qui équivaut à la masse molaire en g/mol). Le poids est la propriété que nous cherchons la plupart du temps sur un tableau de Mendeleïev. Le nombre d’électrons pour chaque couche peut être déterminé à partir de Z mais est souvent indiqué dans le tableau périodique. Aluminium Z = 13 ce qui signifie que la couche n = 1 est complète avec deux électrons, la couche n = 2 est complète avec 8 électrons (2 sur 2s2 et 6 sur 2p6)
et que les trois électrons doivent être distribués dans la couche n = 3. Les deux premiers électrons sont dans 3s2 et le dernier électron est dans une orbitale 2p. De cela nous pouvons déterminer que Al est sur la troisième ligne du tableau (n = 3) dans la troisième colonne (3 électrons sont dans la dernière couche). L’aluminium a un état d’oxydation unique (EO) de +3 (à voir dans une section suivante). Les éléments après la troisième colonne peuvent avoir plusieurs EO en fonction de la façon dont ils utilisent leurs électrons. Enfin, certaines températures sont indiquées pour nous faire savoir dans quel état, solide, liquide ou gazeux, l’élément se trouve à une température donnée.
lignes :
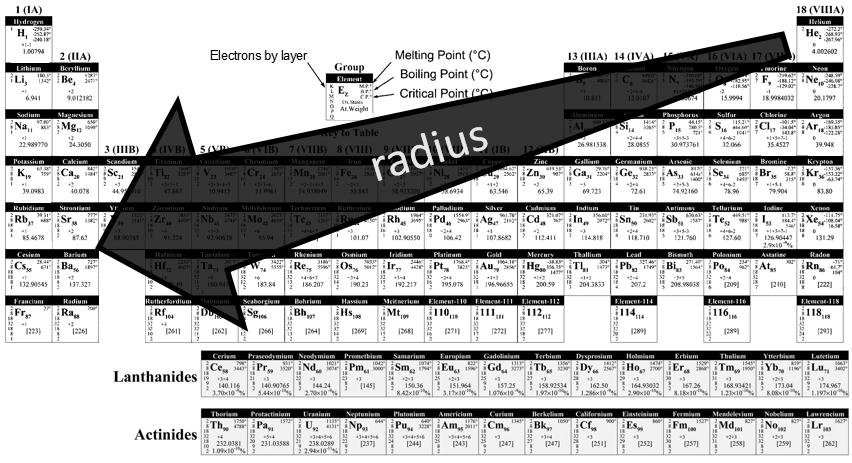
Chaque ligne correspond à une valeur de n. Étant donné qu’une couche d’électrons est ajoutée pour chaque ligne le rayon des éléments augmente quand on descend dans le tableau périodique. Le nombre d’éléments dans une ligne n’est pas identique d’une ligne à l’autre parce que les orbitales p et d ne sont pas présents dans les premières lignes. On peut également voir deux lignes particulières au bas du tableau les lanthanides et les actinides correspondant aux éléments possédant une orbitale nf extérieure.
Colonnes:
Les éléments sur une même colonne ont le même nombre d’électrons de valence. Chaque colonne est appelée une famille et a un nom particulier. Les trois premières colonnes et les 5 dernièrse sont désignées Ia, IIa, IIIa, …, VIIIa et contiennent les principaux éléments. Entre les deux sont situés les métaux de transition notés Ib, IIb, …
Ia (sauf H) : les métaux alcalins : ils sont tous brillants (mais ternissent au contact de l’air), mous, très réactifs (dans les conditions standards de température et de pression) et perdent facilement leurs électrons ultrapériphérique pour former un cation. Ils forment les bases fortes lorsqu’ils sont liés à OH- (NaOH, KOH).
IIa : métaux alcalino-terreux : ils sont tous brillants et réactifs (en sctp). Ils perdent facilement leurs électrons ultrapériphériques pour former un cation de la charge 2+.
IIIa : icosagens ou triels : la colonne de bore et d’aluminium. Ils ont 3 électrons dans leur couche externe. L’aluminium est un des métaux rares à avoir une faible densité.
IVa : crystallogens ou tetrels : le groupe du carbone et du silicium. Ils ont 4 électrons de valence. Le carbone est le composant essentiel des corps vivants (~ 23% d’un être humain) mais il est aussi un constituant de la terre par les carbonates, et de l’atmosphère par du CO2. Il est très résistant à la chaleur. Le silicium est un constituant majeur de la terre le deuxième en abondance. Si et C sont dans la même colonne mais sont étonnamment différents. Une de leurs propriétés communes c’est qu’ils peuvent faire de longues chaînes (C cependant peut faire des chaînes beaucoup plus longues que Si ). C peut former des liaisons pi tandis que Si ne peut pas parce que son rayon est trop grand ( la superposition des orbitales est impossible). CO2 est un gaz tandis que SiO2 est un solide (quartz) qui est la base des matériaux en verre.
Va : pnictogens : le groupe de l’azote et du phosphore. Ils ont 5 électrons de valence, dont deux jumelés. Ils forment des liaisons covalentes stables et peuvent former des liaisons doubles et triples. Cette aptitude à former des liaisons persistantes est la source de la toxicité de certains éléments de ce groupe (arsenic, antimoine). D’autre part N2 est un gaz inerte qui représente 78% de l’air.
VIa : halcogènes : le groupe de l’oxygène et du soufre. L’oxygène a des propriétés très différentes de celles du reste de ce groupe : les éléments de ce groupe sont doux et ne conduisent pas bien la chaleur. L’oxygène constitue 21% de l’atmosphère, 46% de la croûte terrestre en poids et 65% du corps humain. L’oxygène se produit également dans de nombreux minéraux, étant trouvé dans tous les minéraux d’oxyde et d’hydroxyde minéraux, et dans de nombreux autres minéraux. L’ozone est formé spontanément dans la haute atmosphère où il attrape les rayons UV du soleil
Le radical émis va réagir immédiatement avec une molécule voisine. L’ozone est un meilleur oxydant que O2 car une liaison pi est délocalisée. En conséquence l’ozone est souvent utilisé pour tuer les bactéries sans gaspillage.
VIIa : Halogènes : Tous les halogènes forment des acides lorsqu’ils sont liés à un atome d’hydrogène et sont généralement toxiques. Ils forment également des sels quand ils font des liaisons avec des produits alcalins.
VIIIa : gaz noble/gaz Rare: ces éléments sont inertes, ils ne réagissent avec aucun autre élément. L’hélium est l’élément le plus commun dans l’univers (~ 24% de sa masse). En raison de leur manque de réactivité on les utilise dans l’éclairage (également vrai pour l’azote)
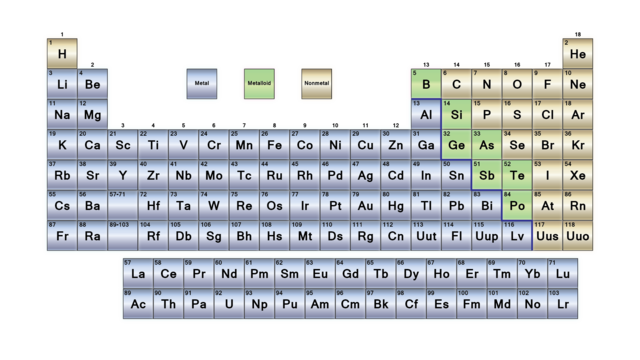
Les métaux, non-métaux, métalloïdes :
Le tableau périodique peut être divisé en trois grandes sections : métaux, non-métaux, métalloïdes. Ces trois catégories sont bien regroupées dans le tableau (sauf H comme toujours). La plupart des éléments sont des métaux. Les non-métaux sont sur le coin supérieur droit du tableau (+ H) et les métalloïdes sont des éléments situés sur une diagonale allant de Bore au Polonium.
Métaux :
Les métaux ont une bonne conductivité thermique et électrique. Comme une vaste catégorie ils ont des propriétés communes mais des exceptions existent pour plusieurs d’entr’ eux (pour une ou plusieurs propriétés).
Ils ont en général une énergie d’ionisation faible, une faible électronégativité et, quand ils font des liaisons, ils donnent ou partagent leurs électrons. La liaison de deux ou plusieurs métaux forme un alliage. La plupart d’entre eux peuvent former des oxydes et se trouvent naturellement dans cet état.
En général ils sont solides mous et malléables de haute densité mais certains sont des liquides dans les conditions naturelles (Hg par exemple). La plupart d’entre eux sont de couleur argentée.
Non-métaux :
La plupart des non-métaux sont des gaz de faible densité dans les conditions naturelles. Quand ils font des liaisons ils partagent ou acceptent des électrons et ne font pas d’oxydes basiques (mais ils forment des oxydes acides comme HClO, H2SO4, etc). En opposition au métaux ils ne conduisent pas l’électricité, la chaleur et ils ont une énergie d’ionisation et électronégativité élevée. Habituellement dans la nature ils ne se trouvent pas dans un état combiné.
Métalloïdes :
Ils sont la minorité des éléments. Ils ressemblent à des solides métalliques et peuvent former des oxydes (acide, base ou amphotères). La plupart sont des semi-conducteurs et des conducteurs thermiques modérés, et ont des structures qui sont plus ouvertes que ceux de la plupart des métaux.
Propriétés périodiques :
Rayon atomique:
plusieurs types de rayons peuvent être déterminés pour un seul élément.
Rayon cristallin : un cristal est un solide dans lequel les atomes sont disposés dans l’espace. Les monocristaux sont obtenus à partir de l’agrégation des atomes sur un atome unique. Ils ont l’avantage d’avoir moins de défauts dans la structure que des cristaux disposés autour de plusieurs sources. Les cristaux ne sont pas nécessairement constitués à partir d’un seul élément, on peut par exemple, faire des cristaux de protéines afin de déterminer leur structure spatiale.
Le procédé pour obtenir des cristaux est le suivant : l’élément du cristal est d’abord dissout dans un solvant, la dissolution peut être aidée par une augmentation de la température. Une fois la dissolution terminée, le but est de diminuer très lentement l’affinité de l’élément avec le solvant. Il peut être fait par l’évaporation du solvant (un autre solvant de faible affinité remplace le solvant évaporé) ou si la solution est chauffée, par une lente diminution de la température. Le processus doit être lent pour éviter la formation de plusieurs centres d’agrégation.
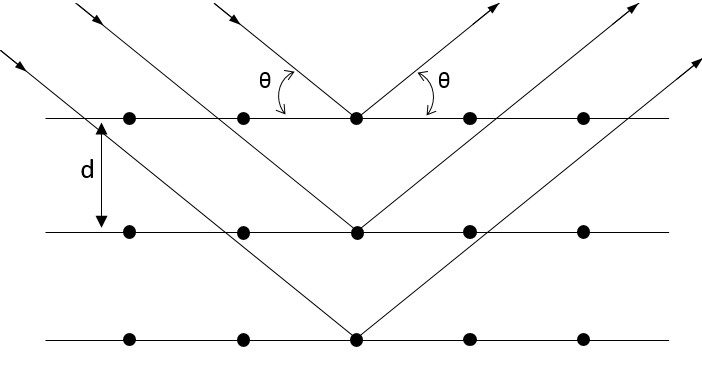
La structure des cristaux et la distance entre les atomes dans un cristal dépendent de ses éléments constitutifs et peut être déterminée par diffraction au RX.
Dans ce procédé un faisceau de RX frappe la surface d’un cristal avec un angle θ donné :
L’interaction de ce faisceau avec les atomes des premières couches du cristal. Cette interaction donne lieu à la diffraction seulement si :
Où d est la distance entre les couches dans le cristal, θ l’angle d’incidence et la longueur d’onde λ du faisceau. Cette équation est l’équation de Bragg. Si ces conditions ne sont pas remplies l’interaction entre les atomes et le faisseau est destructif (c-à-d qu’ils s’annulent) et la diffraction ne se produit pas. Le rayon est la moitié de la distance entre les atomes dans le cristal.
Rayon Calculé : on considère ici que le rayon pour lequel la probabilité de présence de l’électron est le plus grand est le rayon de l’atome.
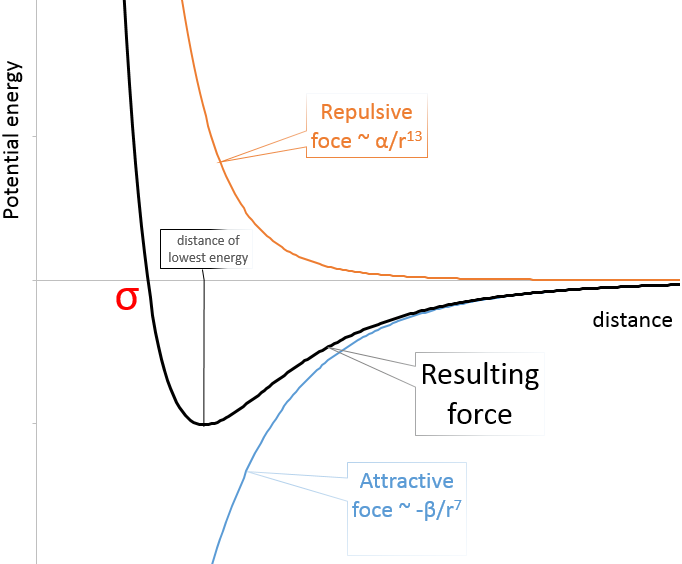
Rayon de Van der Waals : Le rayon de Van der Waals est obtenu par l’addition de la force répulsive et la force attractive entre deux atomes. Ces deux forces dépendent de la distance séparant les atomes mais pas de la même façon. L’attraction est proportionnelle au rayon à la puissance -7 tandis que la répulsion l’est à la puissance -13. En conséquence il existe une distance favorable entre les atomes quand ils se lient. Il est la fosse d’attraction. Réduire cette distance augmente considérablement l’énergie potentielle. σ est la distance favorable la plus petite et est à l’intersection entre la courbe et Epot = 0. L’augmentation de la distance augmente également l’énergie potentielle vers 0.
Le rayon de l’atome peut être déterminée à partir de σ.
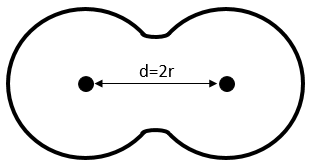
Rayon covalent : pour les molécules diatomiques le rayon de l’atome est considéré comme la moitié de la longueur de la liaison.
Rayon empirique : il est obtenu à partir du volume du gaz atomique. Dans un volume donné de gaz il existe un nombre donné d’atomes. Considérant les atomes sphériques le volume d’un atome est V=4/3π r3. Par conséquent le rayon est déterminé.
Ces différents rayons ne sont pas égaux et dans certains cas ils n’existent pas. Par exemple, il n’existe pas de rayon covalent pour He. Toutefois chacuns d’eux suivent la même répartition logique dans la table périodique :
Comme nous l’avons vu dans la section précédente une couche d’électrons est ajouté à chaque nouvelle ligne du tableau périodique. Il est donc logique que le rayon des éléments augmente dans une seule colonne. Se déplaçant à travers une ligne le nombre de protons dans le noyau augmente et les électrons externes sont ainsi de plus en plus attirés par le noyau. De gauche à droite le rayon diminue. En conséquence Li et Mg ont un rayon similaire, de même que Na et Ca.
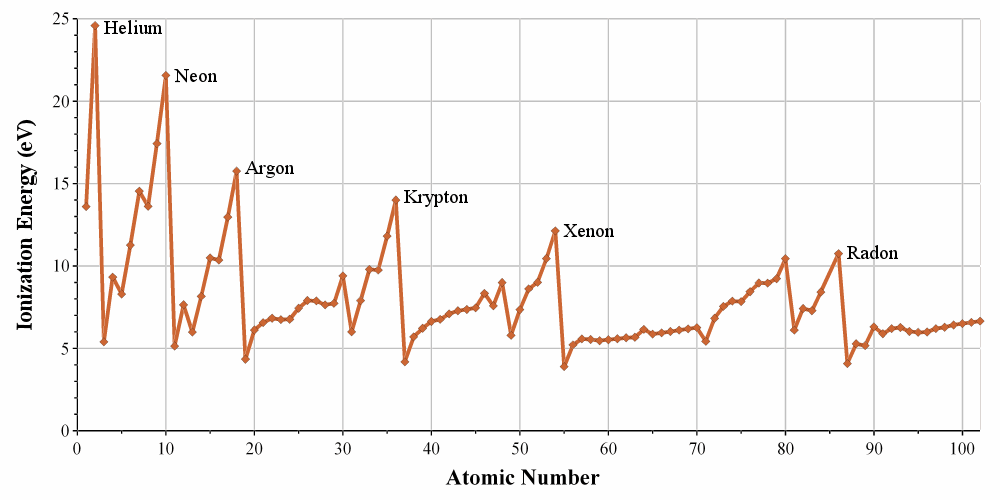
L’énergie d’ionisation :
l’énergie d’ionisation (IE) est l’énergie nécessaire pour enlever un électron d’un atome d’un gaz :
Cette énergie est positive (les atomes dans le gaz ne perdent pas leurs électrons spontanément) et dépend de l’énergie de l’électron : un électron proche du noyau est plus difficile à enlever. Il est également beaucoup plus difficile à retirer un deuxième électron d’un atome qui en a déjà perdu un. Par exemple l’aluminium a des énergies d’ionisation suivantes :
Le premier électron est relativement facile à enlever : c’ est le seul électron sur l’orbitale 3p de l’aluminium. L’électron suivant est beaucoup plus difficile à enlever : c’est un électron sur une orbitale complète. La troisième énergie d’ionisation est petite, pour une troisième ionisation : on obtient la structure électronique du néon gazeux noble : l’octet est terminée et cette structure est stabilisée. Cette stabilisation est visible dans la prochaine énergie d’ionisation : une énergie gigantesque est nécessaire pour enlever un électron supplémentaire.
Les énergies de l’ionisation sont périodiques sur le tableau de Mendeleïev. Il nécessite une énergie massive pour arracher un électron à partir d’un gaz noble mais il est plus facile d’aller vers sa structure électronique. Dans une période/ligne on peut voir que la tendance de l’IE n’est pas linéaire. Il est plus difficile que la moyenne pour enlever un électron d’une orbitale complète.
Il est plus facile d’enlever un électron apparié (moins de répulsion).
Il est plus facile de vider l’orbitale : le dernier électron est protégé par les électrons des orbitales intérieures.
Pour la même dernière raison l’IE diminue lors du déplacement vers le bas dans le tableau périodique : l’effet de blindage est plus grand et plus grand avec le nombre de couches d’électrons.
Electroaffinité :
l’ électroaffinité est tout le contraire de l’ionisation : il est l’énergie requise par un atome gazeux à accepter un électron supplémentaire et suivre l’évolution opposée à la IE.
A noter que les gaz rares ne possèdent pas d’électroaffinité car ils sont inertes.
Electronégativité :
l’électronégativité est une notion importante dans la chimie : c’est la capacité d’un atome à attirer les électrons d’une liaison qu’elle partage. Le symbole de l’électronégativité est χ.
Pauling a déterminé que, par convention, le fluor(ayant la plus grande électronégativité) a un χ = 4. Les autres éléments ont une électronégativité donnée par :
Où DXY est l’énergie de dissociation entre X et Y soit l’énergie nécessaire pour rompre une liaison entre X et Y.
Le fluor est dans le coin en haut à droite du tableau il est difficile de comprendre la tendance pour l’électronégativité.