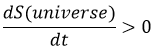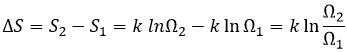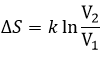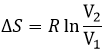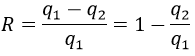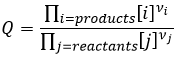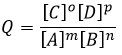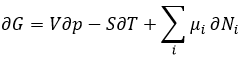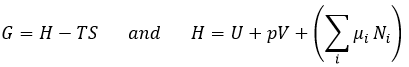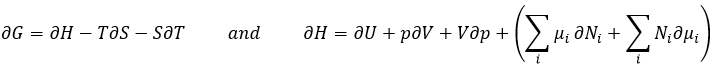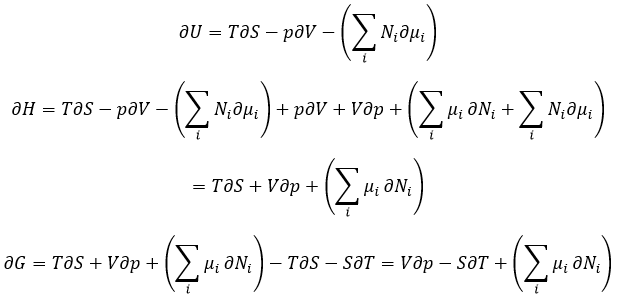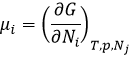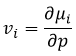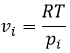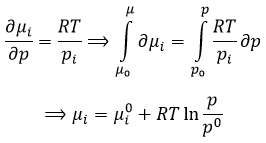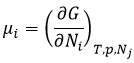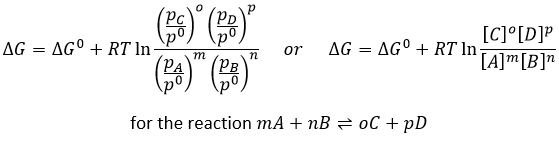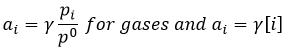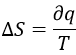Deuxième principe :
Augmentation de l’entropie : l’entropie dans l’univers augmente au fil du temps.
L’entropie est une mesure du trouble d’un système. La deuxième loi de la thermodynamique a plusieurs formulations mais la plus commune est que le processus est si spontané, sans influence extérieure (système isolé), il induit une augmentation de l’entropie dans l’univers.
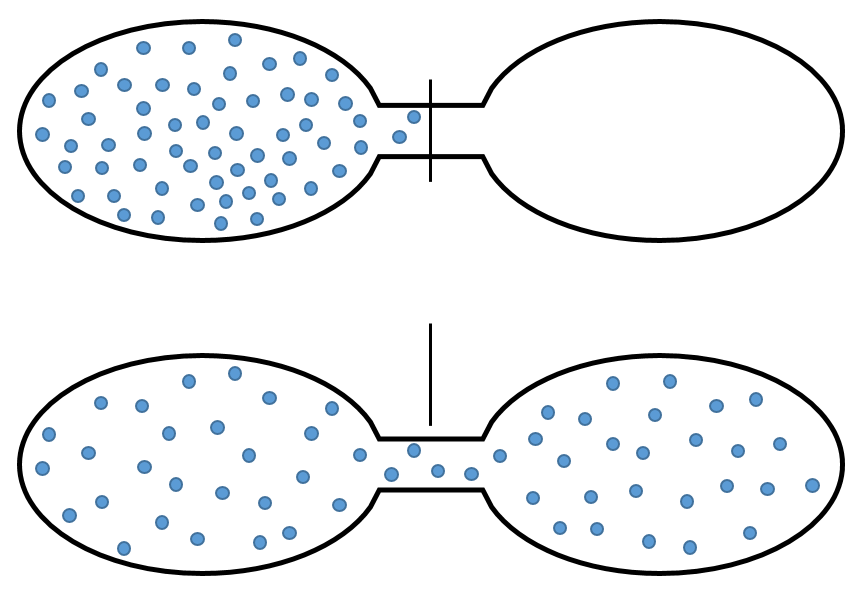
Par exemple si deux réservoirs sont reliés, l’un étant vide et l’autre plein de gaz, le gaz aura spontanément occupé l’ensemble du système même s’il ne comporte pas de variation de l’énergie.
Le gaz se dilate car il y a plus de postes à occuper dans un plus grand volume. Une autre définition de l’entropie est un système qui tend à changer à l’état le plus probable.
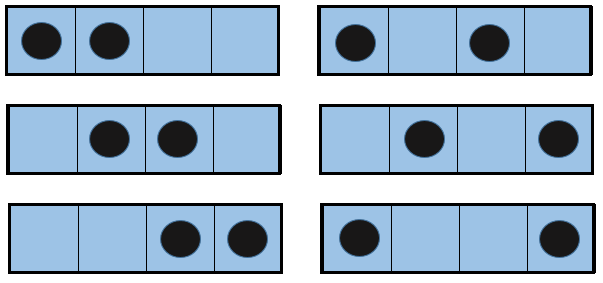
Imaginez une petite boîte avec seulement quelques postes disponibles. Deux particules sont dans cette boîte et chacune occupe un seul endroit. Plusieurs combinaisons sont possibles :
Si nous augmentons le volume de la boîte la quantité de possibilités augmente de façon exponentielle. Il est une entropie de la position/disposition. La formule de ce genre d’entropie pour une particule est :
Ω étant la quantité de configurations possibles pour cette particule.
Si le volume contenant cette particule passe d’un volume V1 à un volume V2, la variation de l’entropie est :
Le nombre de positions pour une particule est directement proportionnelle au volume et :
Pour les gaz dilués le volume des particules est négligeable en ce qui concerne le volume du système. En conséquence nous pouvons à peine ignorer la présence d’autres particules dans la formule et dire que pour les particules NA (1 mole) :
Nous avons vu plus tôt que dans la dilatation d’un gaz l’énergie était une fonction d’état mais que le travail et la chaleur ne l’étaient pas et donc la façon dont le processus se déroule a une influence sur le travail et sur la chaleur. La troisième voie que nous avons discutée a été le processus isotherme pour lequel nous avons trouvé une expression pour le travail :
Ce processus étant isotherme par conséquent :
ΔE=q+W=0.
Nous pouvons donc trouver la variation d’entropie pour ce processus à partir de la chaleur. Si le gaz se dilate la chaleur pénètre dans le système (il sera un processus endothermique).
La variation d’entropie est donc équivalente à la quantité de chaleur que le gaz doit absorber pour maintenir sa température constante.
Les états de la matière n’ont pas la même entropie. Un gaz a une entropie supérieure à un liquide et celui-ci a une entropie plus grand que celle d’un solide. Nous pouvons facilement le comprendre par l’utilisation de la répartition des particules dans une petite boîte.
Dans un gaz (parfait) les particules n’ont pas d’interactions entre elles. Elles peuvent donc occuper une position quelconque du volume sans restriction. Dans un liquide les particules interagissent ensemble et restent groupées, mais la forme de leur assemblage n’ est pas fixe. Les possibilités sont donc plus limitées que pour un gaz. Dans un solide les particules sont complètement fixes dans une forme donnée. Les positions qu’un solide peut prendre sont donc plus limitées que celles qu’ un liquide peut prendre et de la même façon celles d’un liquide sont plus limitées que pour un gaz.
Il existe des tables d’entropies standards sur lesquelles on peut trouver l’entropie des molécules dans un état donné à 298K.
Pour résumer plusieurs cas peuvent être distingués. Un processus se produit si la production d’entropie dans l’univers est positif. Cette production d’entropie est composée de la variation de l’entropie dans le système et dans l’environnement. L’un de ces composants de l’entropie peut être négatif si l’autre composant est positif et plus grand en valeur absolue.
Quand une réaction produit un gaz la variation de l’entropie est positive. Si cette réaction est exothermique la chaleur est transmise à l’environnement ce qui signifie que son entropie augmente. Cette réaction est donc spontanée. Si la réaction est endothermique la variation de l’entropie de l’environnement aurait été négative. La réaction peut encore être spontanée si la production d’entropie de la réaction est supérieure à la diminution de l’entropie dans l’environnement.
Cycle de Carnot :
Nicolas Léonard Sadi Carnot a proposé un moyen de convertir l’énergie thermique en travail. C’est un cycle thermodynamique, à savoir une série de transformations de l’Etat qui ramène à l’état initial, composé de deux processus isothermes (pas de variation de température) et deux processus adiabatiques (pas d’échange de chaleur avec l’environnement). Tous les processus sont réversibles et le cycle peut donc être fait dans le sens inverse : la conversion de travail en une différence de température.
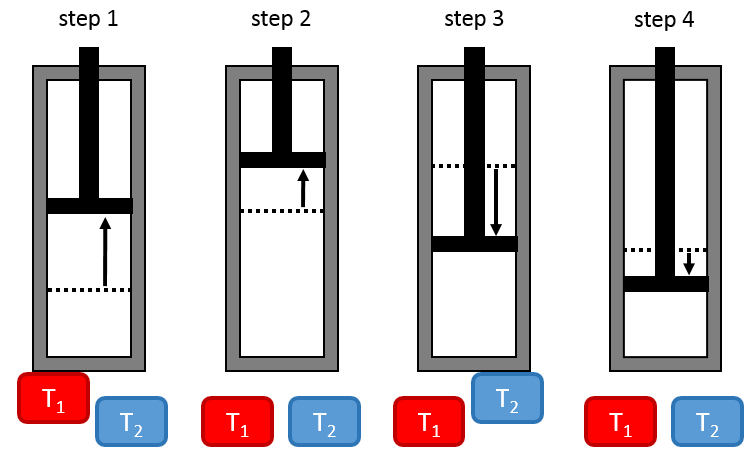
L’installation est constituée d’un réservoir dont le volume peut varier et qui peut être en contact avec deux corps ayant une température de T1 et T2 respectivement, T1 étant supérieur à T2 .
Première étape : l’expansion isotherme du gaz au T1. Le réservoir est en contact avec le corps chaud à T1. La chaleur q1 est échangée entre le corps et le réservoir de gaz qui se dilate sans variation de température. Il y a donc une variation de l’entropie :
ΔS1=q1/T1.
Deuxième étape : l’expansion adiabatique du gaz. Au cours de cette deuxième étape il n’y a pas d’échange de chaleur mais le volume du gaz continue à augmenter, faire du travail sur le piston et se refroidir du T1 au T2. Le corps à T = T1 n’est plus en contact avec le réservoir. Comme il n’y a pas d’échange de chaleur, il n’y a pas de variation de l’entropie.
Troisième étape : la compression isotherme du gaz au T2. Le réservoir est maintenant en contact avec le second corps à T = T2 ce qui provoque un transfert de chaleur q2 tandis qu’une compression est appliquée par le piston en maintenant la température constante. Il y a donc une variation de l’entropie :
ΔS2=q2/T2.
Quatrième étape : la compression adiabatique du gaz. Le corps à T = T2 n’est plus en contact et il n’y a pas de possibilité de transfert de chaleur. Le volume du gaz continue à diminuer tandis que sa température change de T = T2 à T = T1. A la fin de cette étape le système est à nouveau dans les conditions (volume, température et pression) de l’état initial.
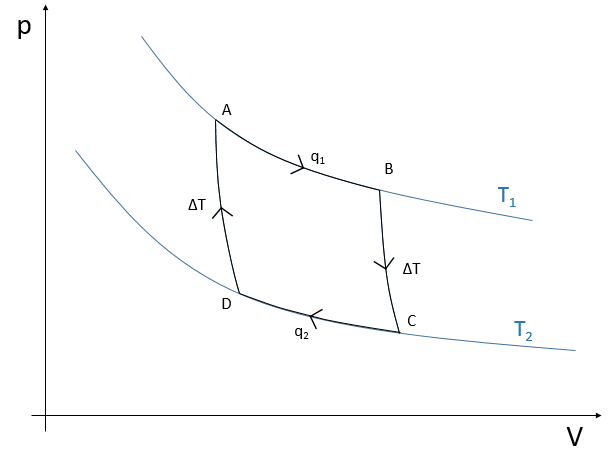
Le cycle peut être tracé dans le diagramme de phase pV comme indiqué ci-dessous :
L’efficacité de la R = W/q1 du cycle de Carnot serait de 100% si tout le travail W a été transformé en chaleur q. Le travail ici est la différence du chauffage q1-q2 parce AE = 0 = q + W (système isolé, les organismes à T1 et T2 étant dans le système). Par conséquent :
Il est possible de montrer que le rapport q2/q1 est égal au rapport T2/T1.
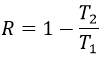
La conséquence est que l’efficacité n’est jamais de 100%, sauf au T2 = 0 K, que nous ne pouvons pas atteindre sur la terre. La perte d’énergie est provoquée par la production d’entropie.
L’ énergie libre de Gibbs :
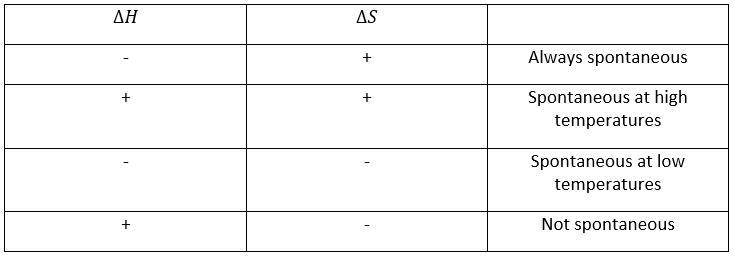
Pour qu’une réaction se produise nous venons de voir que deux facteurs sont importants : l’enthalpie de réaction (si la réaction est exo ou endothermique) et la variation de l’entropie. L’énergie libre de Gibbs Ag regroupe les deux facteurs dans une équation :
Une réaction est spontanée si ΔG<0. La relation d’entropie et la température montrent clairement que la réaction peut être spontanée à une température donnée mais pas si la température est modifiée :
Nous pouvons trouver des tables pour des valeurs standard de ΔH0 et ΔS0 et, par conséquent, de ΔG0 pour les réactions de formations de molécules. À différentes températures et à 1 atm, la relation est :
Q est le coefficient réactif que nous avons déjà rencontré précédemment :
Par exemple, le coefficient réactif de cette réaction :
est
Si ΔG est négative, la réaction va vers la droite, si elle est positive, la réaction va vers la gauche. Si ΔG=0, nous sommes à l’équilibre. En conséquence nous pouvons trouver une relation reliant la constante d’équilibre K avec l’énergie libre de Gibbs :
Le potentiel chimique :
Le potentiel chimique μi est l’énergie d’une molécule i qui peut être utilisé au cours d’une réaction ou d’un procédé physique.
L’équation de Gibbs-Duheim :
Le dernier terme est donc une variation de l’énergie dans le système due à une variation de la quantité de particules dans le système, quelque chose que nous ne prenions pas en compte avant (il sera indiqué entre parenthèses dans les prochaines équations). La relation ci-dessus provient de la définition de G et de H :
Les dérivées partielles de ces fonctions sont :
Nous avons vu que l’énergie interne ∂U = ∂q + ∂W- (∑iNi∂μi) et que ∂S = ∂q / T et que ∂W = -p∂V. Par conséquent :
Le potentiel chimique est donc la variation de l’énergie libre de Gibbs à l’égard de la variation de concentration d’une espèce spécifique en maintenant les autres paramètres (p, T et les concentrations des autres espèces) constants :
Nous définissons également le volume molaire partiel :
C’est utile pour les gaz. De la loi des gaz parfaits :
Cela nous amène à l’expression du potentiel chimique d’un gaz :
En solution la formule est très semblable :
nous savons que :
Donc nous pouvons trouver l’expression de ΔG comme une fonction des pressions ou des concentrations des espèces :
Pourtant cela est seulement vrai pour des solutions et des gaz parfaits. Normalement nous devons considérer l’activité (a) de chaque molécule :
γ est égal à 1 pour les solutions idéales mais peut varier si la concentration augmente ce qui représente l’augmentation des interactions entre les espèces. Cependant l’activité a de solides est égale à 1.
Troisième principe :
L’entropie d’un cristal parfait au zéro absolu est exactement égale à zéro.
La troisième loi constitue une référence pour l’entropie d’un cristal pur (et donc à quoi que ce soit) à toute température. Un cristal parfait et pur est un cristal dont la disposition est parfaitement organisée : il n’y a pas de défaut, la matrice est régulière et il est composé par une espèce. Au zéro absolu, soit zéro Kelvin, l’état du système est au niveau le moins possible d’énergie. Cet état est unique en raison de la mécanique quantique et c’est effectivement le cas : il n’y a qu’une seule façon de placer les atomes dans un cristal parfait. La quantité de configurations possibles est donc une, ce qui conduit à une entropie égale à :
Si un état de base est dégénéré, à savoir qu’il y a plusieurs états de même énergie, il existe plusieurs différentes configurations possibles pour Ω et l’entropie n’est pas égale à 0 mais est très proche de lui. Dès qu’il y a un défaut dans le cristal la quantité de configurations possibles augmente et l’entropie aussi, conduisant à une certaine énergie que la seconde loi, nous dit que :
L’élévation de température dT due à la chaleur ∂Q est déterminée par la capacité calorifique (cp ≈ CV) du cristal :
Les conséquences de la troisième loi :
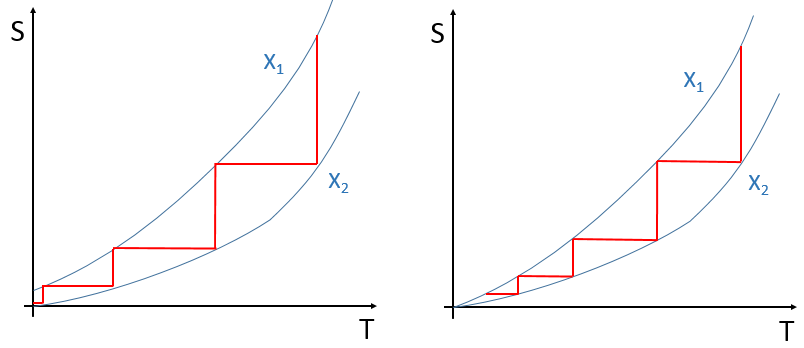
Une première conséquence de la troisième loi est que T = 0 K ne peut être atteint par aucun nombre de processus finis. C’est dû au fait qu’il n’y a qu’un seul état d’énergie minimum. Si nous essayons de changer un paramètre donné d’une manière contrôlée, afin que l’énergie diminue à chaque fois, il faudrait un nombre infini de répétition pour atteindre le zéro absolu. Il est un peu similaire au problème de la balle : si, à chaque période de temps, une balle se déplace de la moitié de la distance nécessaire pour atteindre son objectif, la cible sera abordée, mais jamais atteinte. Si plusieurs états ont été autorisés à T = 0 K, il serait possible de passer le paramètre pour obtenir l’un ou l’autre état : une valeur du paramètre se rapproche du système d’un état et l’autre paramètre se rapproche du système de l’autre état. Avec un seul objectif, nous ne pouvons pas passer d’une valeur du paramètre à l’autre et atteindre l’état final. Nous pouvons visualiser cela comme ceci :
Une deuxième conséquence est que la capacité de chaleur cp et cV tendent vers zéro quand T tend vers zéro.