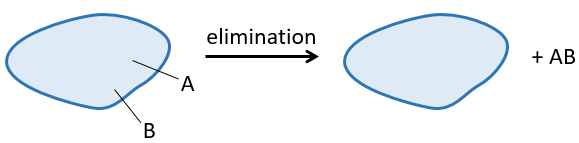
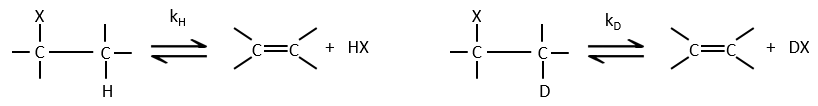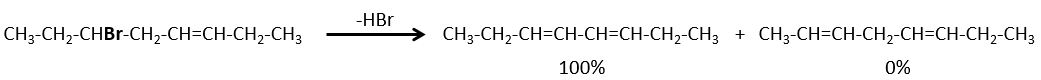Une réaction d’élimination est une réaction au cours de laquelle une molécule perd deux fragments A et B en tant que substrat neutre AB.
Les deux fragments A et B qui sont enlevés peuvent être retirés du même carbone, dans ce cas nous parlons d’une élimination 1,1, de deux atomes de carbone adjacents (élimination 1,2 ou élimination bêta) ou deux atomes de carbone séparés par un atome de carbone (élimination 1,3). L’élimination 1,2 est la plus commune.
L’élimination 1,1 :
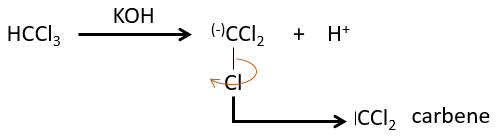
Les deux fragments sont retirés d’un seul carbone. Elle conduit à la formation d’un carbène très réactif.
Cette réaction est possible parce que les atomes de chlore prennent les électrons de l’atome de carbone. A cause de cela, la liaison CH est déstabilisée et une base forte peut enlever le proton.
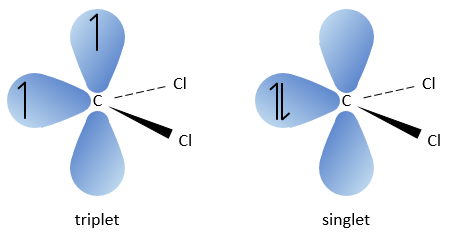
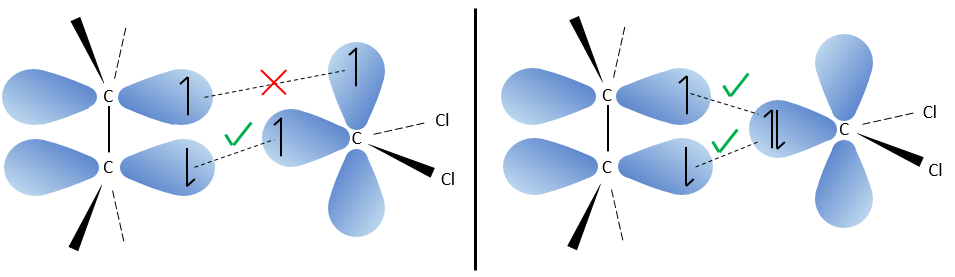
Le carbone du carbène est un singulet et est moins stable que un triplet. Il sera donc réagir rapidement, avec des liaisons doubles, pour obtenir une chaîne de cyclopropane. Un triplet ne serait pas en mesure d’attaquer la liaison π.
La réaction est stéréosélective (sur le même côté du plan).
Le plus petit est le carbène méthylène qui peut être produit à partir de diazométhane (vérifier nom anglais). Le diazométhane est explosif et toxique de sorte que la réaction doit être contrôlée.
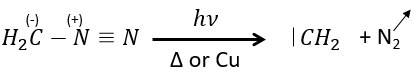
Il peut également être utilisé pour produire des esters méthyliques.
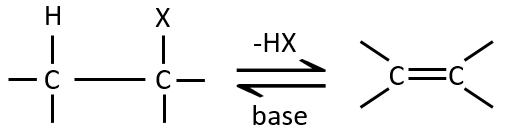
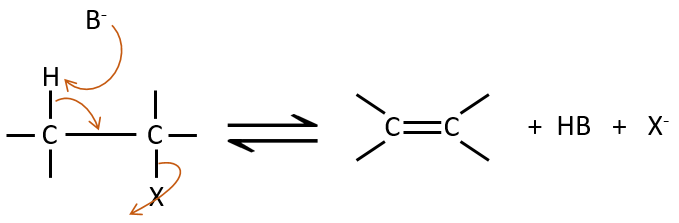
L ‘élimination 1,2 :
Ce type d’élimination conduit à la formation de nouvelles liaisons π. Il est à l’opposé d’une réaction d’addition. Nous discuterons seulement de la réaction principale c-à-d la β élimination mais il peut y avoir d’autres mécanismes impliqués pour obtenir une telle réaction.
Comme pour les substitutions, où il ya un mécanisme avec une cinétique d’ordre 1 (SN1) et une d’ordre 2 (SN2), il y a une élimination d’ordre 1 (E1) et d’ordre 2 (E2).
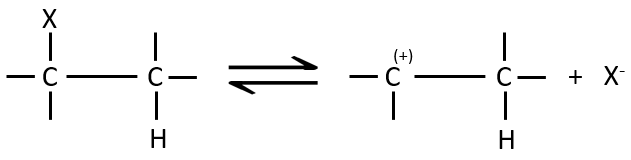
Le mécanisme E1 :
La première étape de la réaction est le départ d’un anion et la formation d’un carbocation. Cette étape est lente et détermine la vitesse de la réaction.
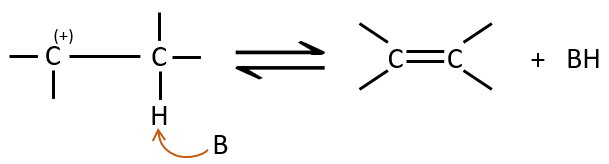
La deuxième étape est la capture d’un proton sur l’atome de carbone adjacent par une base. Il conduit à la formation de la liaison π pour avoir une espèce neutre.
Nous pouvons savoir si une élimination est de l’ordre 1 à partir des éléments suivants :
1- l’ordre de la cinétique de la réaction (ordre 1).
2- l’effet isotopique : si l’hydrogène est remplacé par un deutérium, nous ne voyons pas de modification de la vitesse de réaction. Il en est ainsi parce que l’hydrogène ne participe pas à l’étape de détermination. Si elle a été impliquée, la vitesse serait divisé par 5 à 8.
3- la stabilité du carbocation : la stabilité du carbocation (degré de substitution ou hyperconjugaison) influe sur la vitesse de réaction.
4- les réarrangements: expliqués par l’existence d’un carbocation.
Mécanisme E2 :
La cinétique est d’ordre 2 et implique une réaction en une seule étape, où la prise de proton par la base et le départ du groupe partant sont simultanés.
Cette réaction est possible seulement si le proton et le groupe partant sont en positions anti.
Les arguments en faveur du mécanisme E2 sont :
– Une cinétique d’ordre 2
– Un effet isotopique énorme
– Pas de réarrangement
– Énorme influence de l’énergie de la liaison C-X (X est le groupe partant)
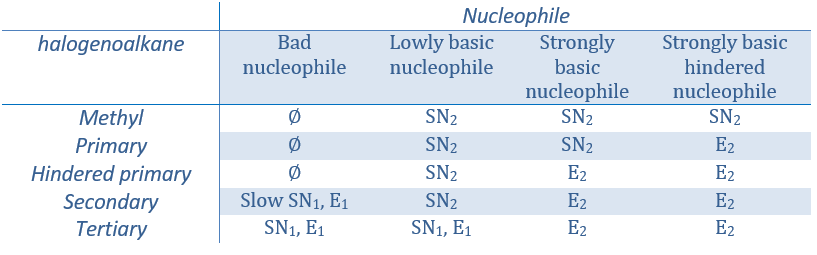
La compétition entre les mécanismes :
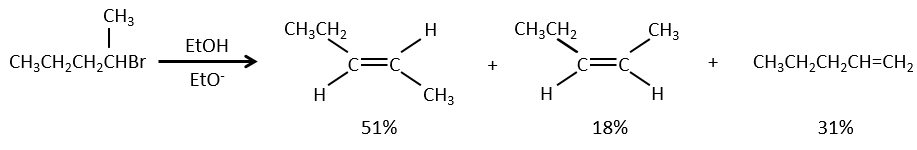
En ce qui concerne les substitutions nucléophiles il existe une compétition entre les deux mécanismes. Ce n’est pas toujours 100% E1 mais plutôt un mélange des deux pour aboutir finalement un mélange racémique des produits. La force de la base et l’encombrement stérique ifluencent le mécanisme d’élimination utilisé : une base forte favorise le mécanisme E2 alors qu’une base faible et un encombrement stérique favorisent le mécanisme E1.
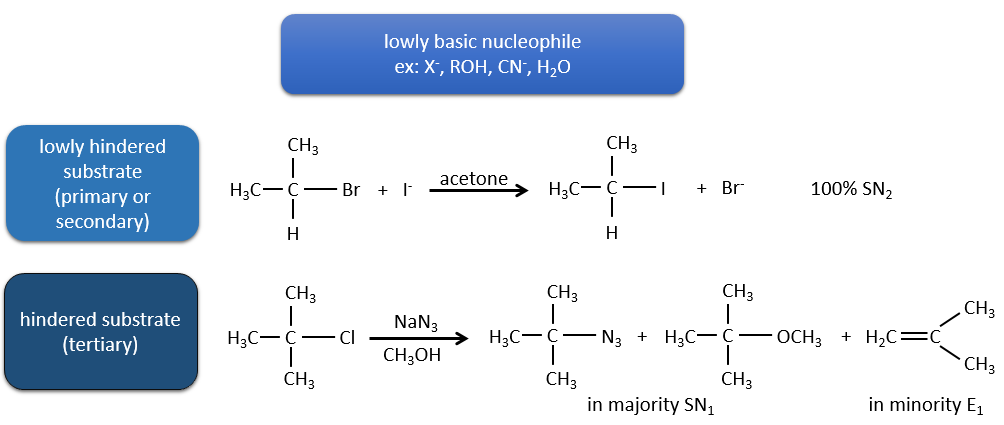
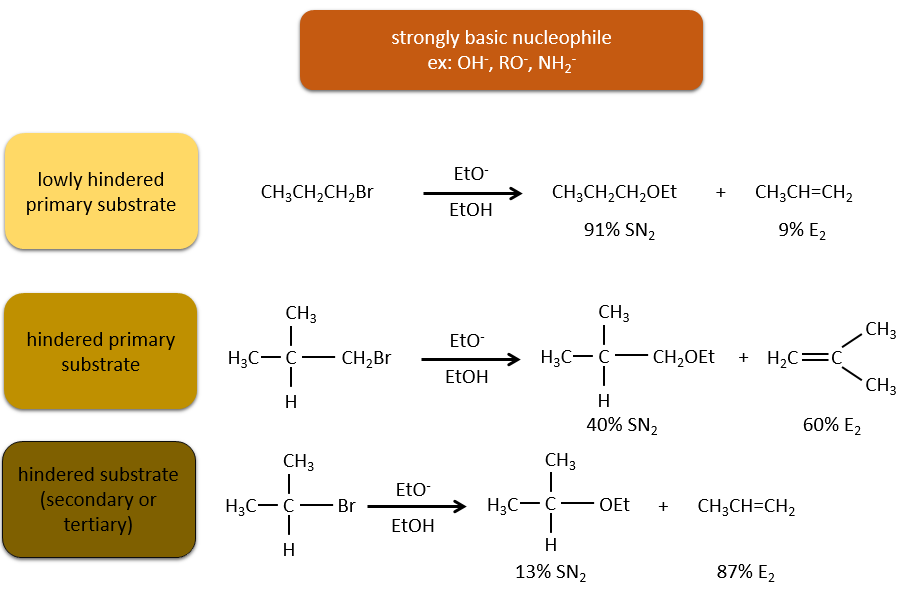
Or, les molécules présentant un bon groupe partant peuvent souvent être aussi l’objet d’une réaction de substitution en présence d’agents nucléophiles. Il existe donc une compétition entre E1, E2, SN1, SN2 et éventuellement d’autres réactions. Les trois principaux paramètres, à prendre en considération pour déterminer laquelle des réactions doit se produire, sont la force de la base, sa nucléophilie et l’encombrement stérique.
Les nucléophiles qui sont mauvais nucléophiles ont de bons rendements avec le SN2 avec des substrats primaires et secondaires. Si l’encombrement stérique est plus grand, le produit principal devient SN1. Si le nucléophile est une base forte, le produit principal est SN2 mais si l’encombrement stérique augmente, l’élimination devient plus importante.
Les nucléophiles qui sont des bases fortes et qui ont un encombrement stérique favorisent l’élimination.
En resumé :
Régiochimie de l’élimination :
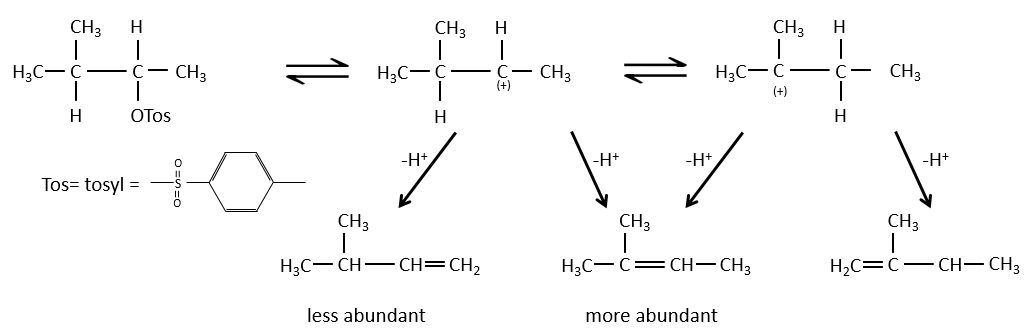
Lorsque le carbone portant le groupe partant n’est pas à une extrémité d’une chaîne, il peut y avoir plusieurs produits possibles. Nous pouvons prédire lequel des hydrogènes sera supprimé.
Si la double liaison générée peut être conjuguée avec d’autres liaisons π, ces produits seront favorisés.
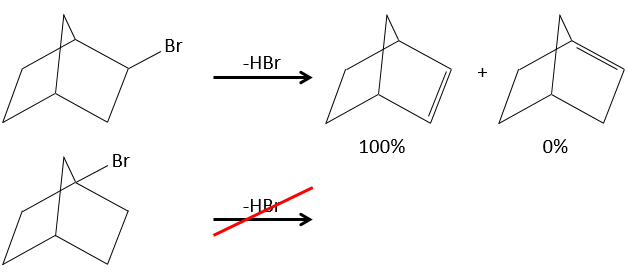
Dans le cas de substrats avec ponts (pontés), le produit n’engage jamais une liaison π sur une tête de pont.
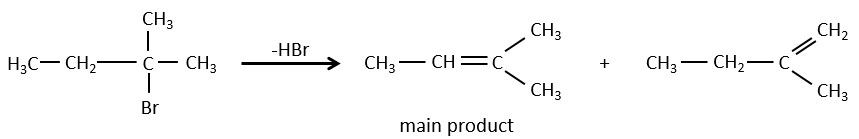
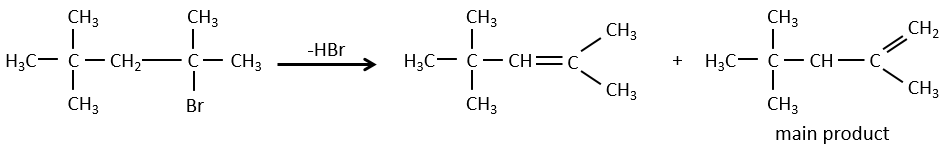
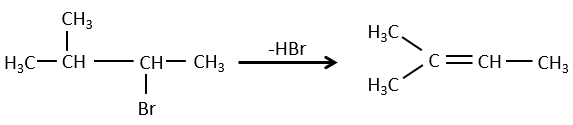
Pour une élimination E1 : l’élimination est déterminée par la stabilité des oléfines formées. Le plus substitué C = C est ainsi favorisé. C’est la règle de Zaitsev.
Il peut y avoir des exceptions en raison de l’encombrement stérique
pour les éliminations E2, une H en anti est requis
la règle de Zaitsev est suivie si le groupe partant n’est pas chargé (la plus substituée C = C)
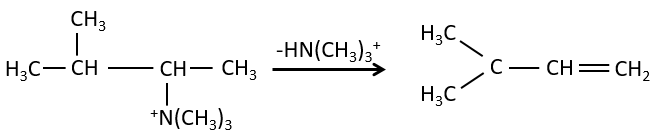
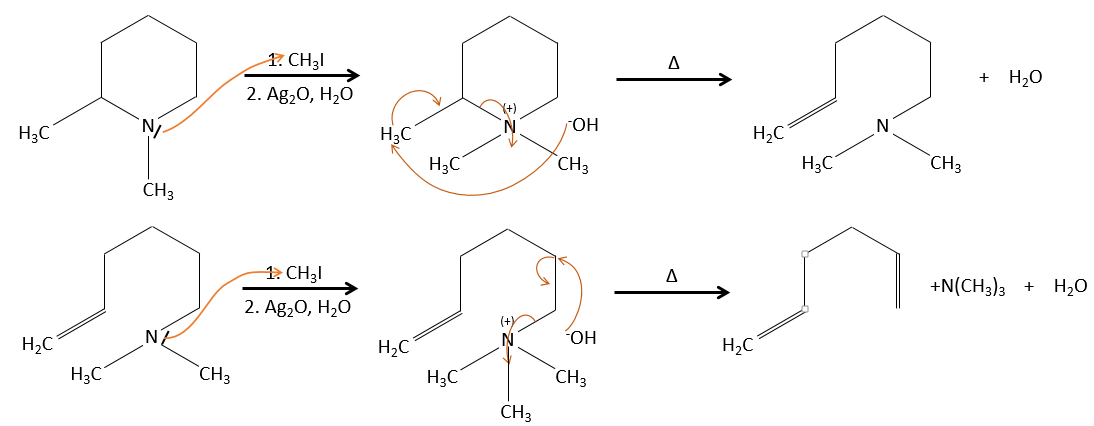
C’est le contraire si le groupe partant est chargé : c’est le règle de Hofmann
dans une telle élimination, c’est le proton le plus acide qui est pris par la base, à savoir l’atome de carbone le plus substitué car il est stabilisé par l’effet donneur mésomérique de la chaîne alkyle .
il peut être un bon moyen pour déterminer la position d’un atome d’azote dans une molécule pour voir si elle est primaire, secondaire, etc.
La configuration du produit :
Dans le cas d’une élimination E2, la réaction est stéréospécifique et il y a donc seulement une seule configuration possible.
Dans le cas d’une élimination E1, le produit est plus stable si les substituants volumineux sont en trans.
La déshydratation des alcools :
Cette élimination ne se produit pas dans des environnements basiques ou neutres : OH– est un mauvais groupe partant et nous aurons former –O– en présence d’une base forte.
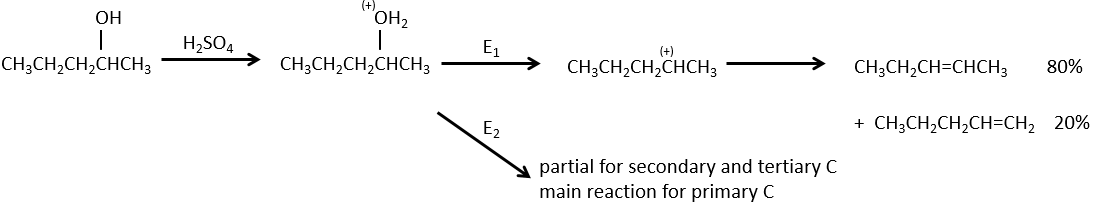
Dans un environnement acide, l’élimination peut se faire par E1 ou par E2 . Le E1 est favorisé dans le cas de produits substitués et E2 est le principal mécanisme de carbones primaires.
Réactivité : tertiaire> secondaire> primaire
E1 E1 E2
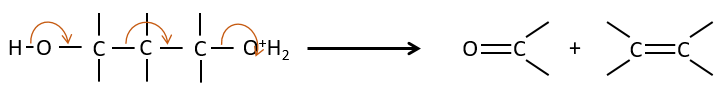
La fragmentation de 1,3 diols :
C’est un cas d’ élimination 1,3 au cours de laquelle la molécule est clivée