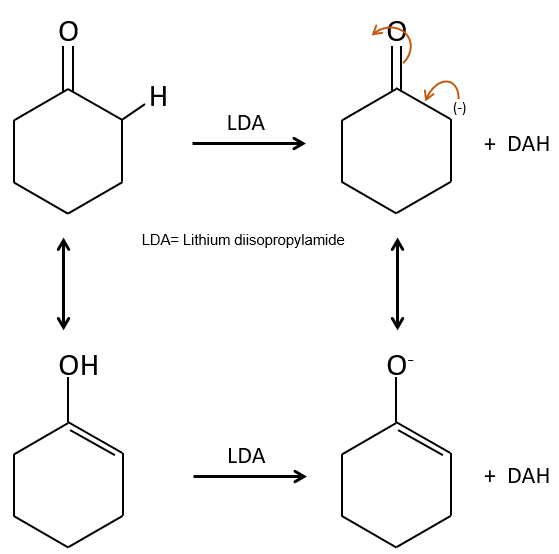
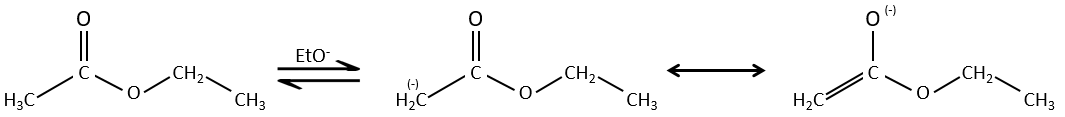
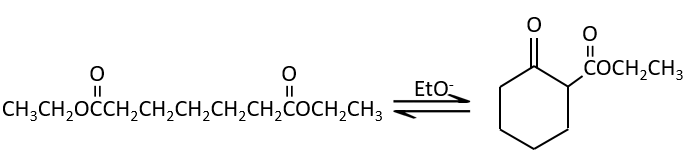Dans la section précédente, nous avons discuté de la possibilité de réaction sur le groupe carbonyle des molécules organiques. Le carbone est un électrophile et l’oxygène est un nucléophile. Cependant la présence d’un groupe carbonyle peut impliquer d’autres processus. Les hydrogènes qui se trouvent sur un carbone voisin d’un groupe carbonyle, à savoir le carbone dans la position α du carbonyle, sont des acides et les bases fortes peuvent les arracher.
Son pKa est d’environ 20 (à titre de comparaison, l’atome d’hydrogène d’un groupe -C-H a un pKa de 40, un a=C-H a un pKa de 37 et -O-H a un pKa de 18). Le résultat est l’ion énolate. Il est stabilisé par résonance avec le carbonyle.
Its pKa is around 20 (for comparison, the hydrogen of a –C-H has a pKa of 40, a =C-H a pKa of 37 and –O-H a pKa of 18). The result is the enolate ion. It is stabilised by resonance with the carbonyl.
Tautomérisation :
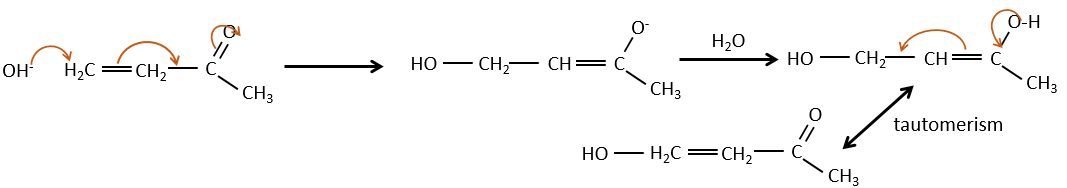
L’ion énolate peut réagir par son atome d’oxygène ou l’atome de carbone en α.
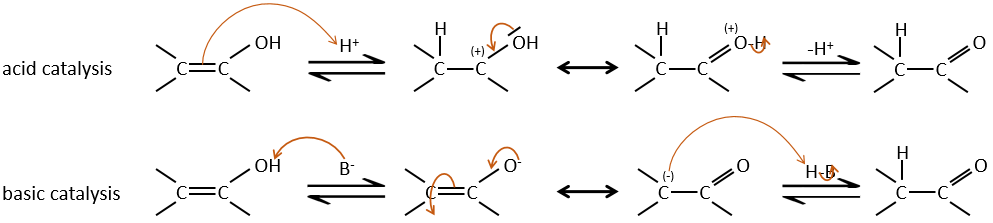
Les Énols sont généralement instables et tautomérisent dans le carbonyle correspondant. C’est la tautomérie énol-cétone. La tautomérisation se fait par catalyse acide ou basique.
La différence d’énergie est d’environ AG = 15kcal en faveur ou de la forme de cétone. L’équilibre énol-cétone peut être déplacé si une forme est stabilisée par la structure de la molécule.
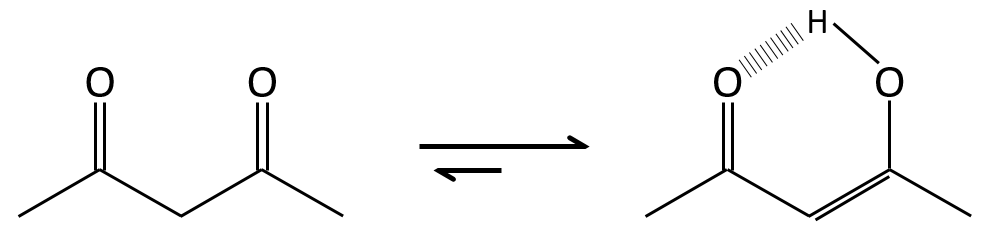
La tautomérisation permet de modifier la conformation de la molécule. Une molécule cis tautomérise pour devenir trans et diminue l’encombrement stérique.
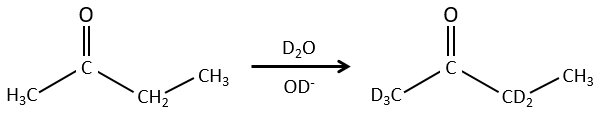
Nous pouvons également échanger l’hydrogène par ses isotopes en raison de la tautomérie.
Les propriétés chimiques des isotopes sont presque identiques (parce que ces propriétés sont données par les électrons) mais certaines propriétés physiques peuvent être différentes entre les isotopes d’un même élément. La vitesse de réaction et la température d’ébullition sont deux exemples de propriétés qui changent en fonction de l’isotope. Il est ainsi possible de séparer les espèces portant des isotopes par distillation ou par centrifugation.
Halogénation :
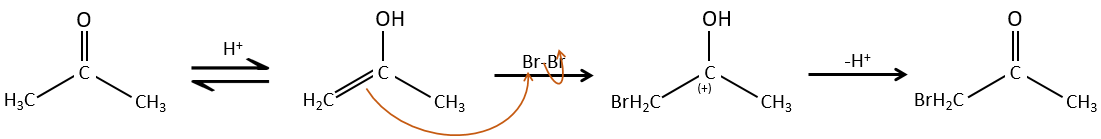
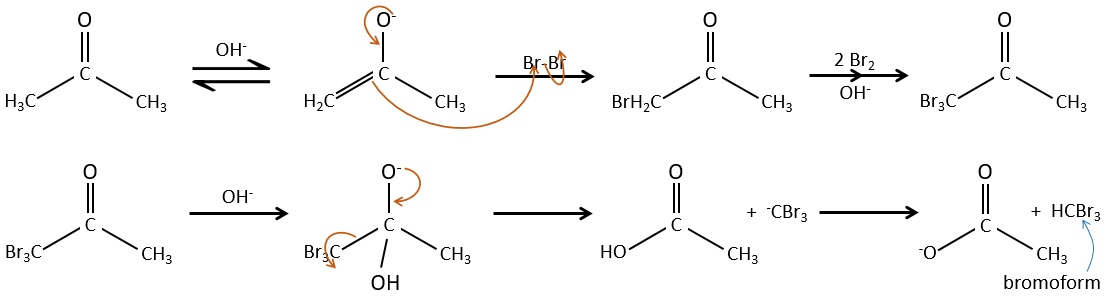
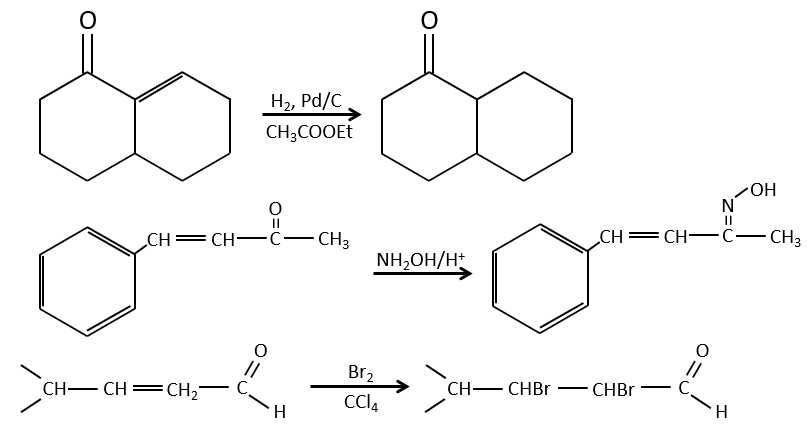
L’hydrogène peut également être remplacé par des halogènes ou par le biais de catalyse de base acide. Dans ce cas, les résultats sont différents selon le catalyseur que nous utilisons.
Une fois qu’un atome d’halogène est sur la molécule, il est plus difficile de former l’énol car il est plus difficile pour C = O d’attraper un proton en raison de l’effet inducteur-capteur de l’halogène.
– La catalyse basique:
Once one halogen is on the molecule, it is harder to form the enol because it is more difficult for C=O to catch a proton due to the inductive captor effect caoteue , of the halogen.
– La catalyse Basique:
Au cours de la catalyse basique nous n’avons pas besoin de protoner le carbonyle et l’halogénation peut avoir lieu autant de fois qu’il y a des protons alpha.
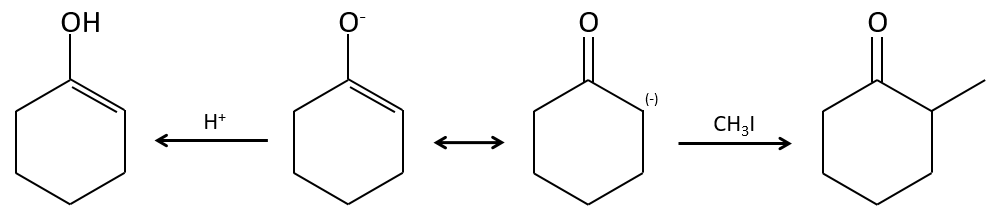
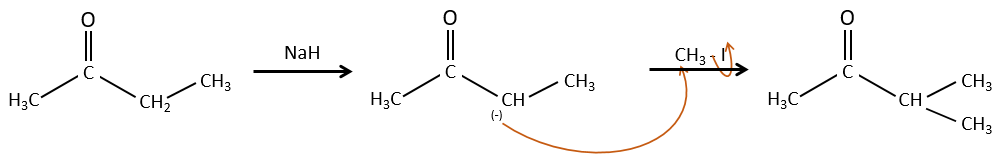
Alkylation :
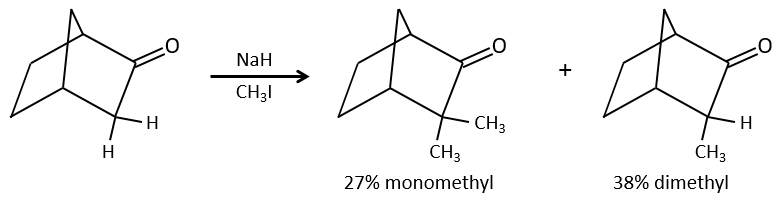
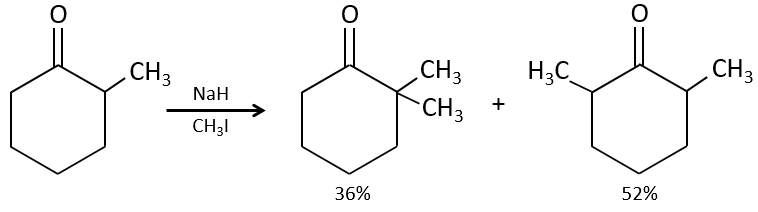
Nous avons vu dans la section précédente que NAH seule ne réduit pas les carbonyles. Cependant il a un effet sur le carbone en α du carbonyle. C’est un bon moyen d’introduire un groupe alkyle à ce poste.
Une base forte peut aussi prendre le proto α de carbonyle.
Le problème c’est que la réaction peut se poursuivre s’il y a plusieurs hydrogènes en α, du carbonyle et polyalkylation est fréquente, ce qui conduit à un mélange racémique des produits.
En outre la régiosélectivité est faible, ce qui donne une possibilité supplémentaire de produit.
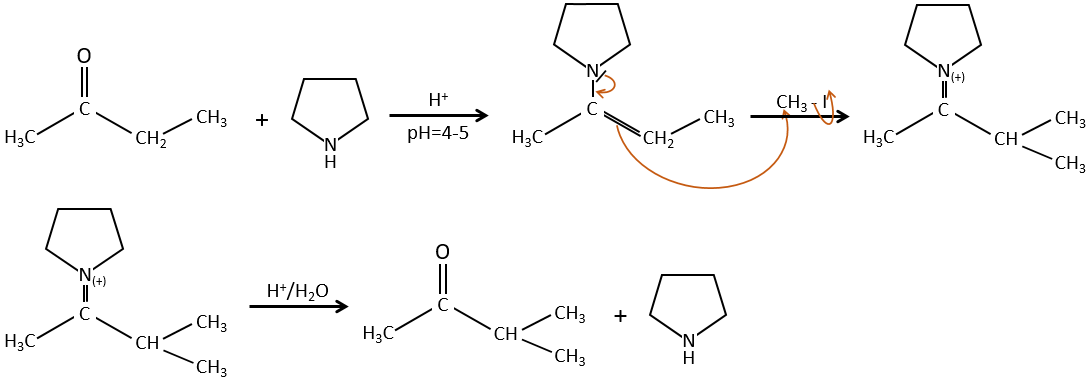
Pour éviter une polyalkylation nous pouvons remplacer l’oxygène par pyrrolidine (C4H9N) pour obtenir l’énamine correspondante qui a l’avantage d’un faible polyalkylation.
Cette protection est également efficace pour les aldéhydes qui sont soumis à la réaction d’aldolisation dans des environnements basiques.
La condensation aldolique :
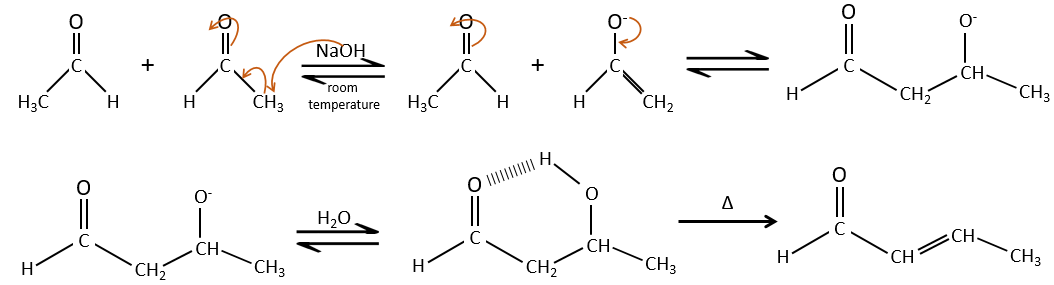
Si nous ajoutons un peu de NaOH dans une solution d’acétaldéhyde des dimères sont formés. La première étape consiste en la déprotonation de l’ α de carbonyl par la base afin d’obtenir l’ion énolate qui attaque le prochain aldéhyde, conduisant à la formation d’un β-hydroxyaldéhyde. La β-hydroxyaldéhyde est stabilisée par sa liaison hydrogène interne.
Si nous chauffons la solution, la molécule perd une molécule d’eau pour former une énone (la double liaison conjuguée avec un groupe carbonyle).
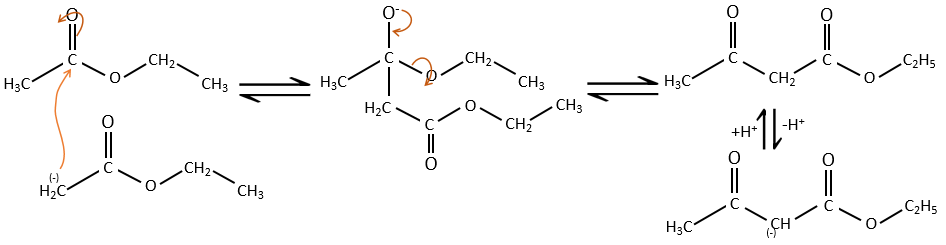
La condensation de Claisen :
La réaction analogue pour les esters est appelé la condensation de Claisen. NaOH n’est pas utilisé dans le cas présent parce que cela donnerait un clivage de l’ether. Nous pouvons utiliser par exemple l’éthylate de sodium pour obtenir l’énolate.
Comme dans la condensation aldolique l’ion énolate attaque un autre ester pour obtenir des ß-cétoesters.
La condensation de Claisen peut être réalisée avec deux esters différents (la condensation mixte de Claisen) ou entre deux esters dans la même molécule (la condensation intramoléculaire de Claisen).
La réaction intramoléculaire est favorisée par rapport à une réaction intermoléculaire car elle ne diminue pas l’entropie.
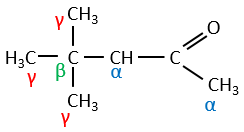
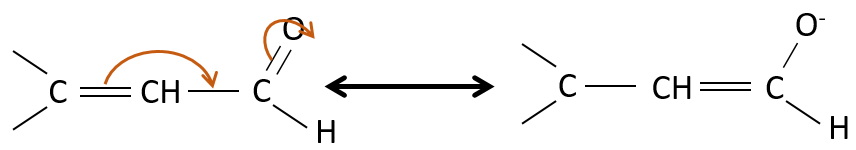
Les propriétés des aldéhydes insaturées α,β et des cétones :
Ces espèces sont stabilisées par résonance.
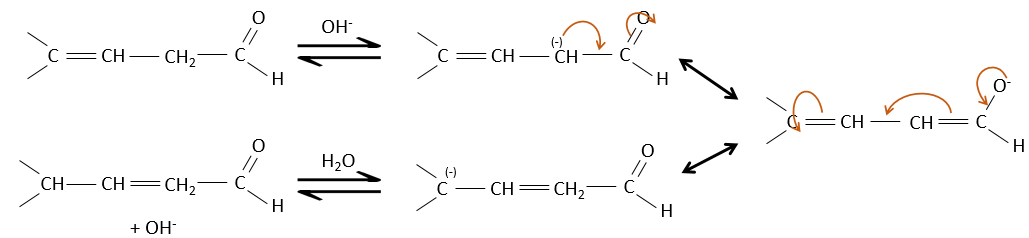
Ies cétones sont beaucoup plus stables que les aldéhydes, les cétones ß,γ-insaturés qui se réarrangent en composé α, β insaturé en présence d’une base.
De toute évidence, la double liaison et les groupes carbonyles peuvent passer par des réactions de façon indépendante, tels que des réactions d’addition par exemple.
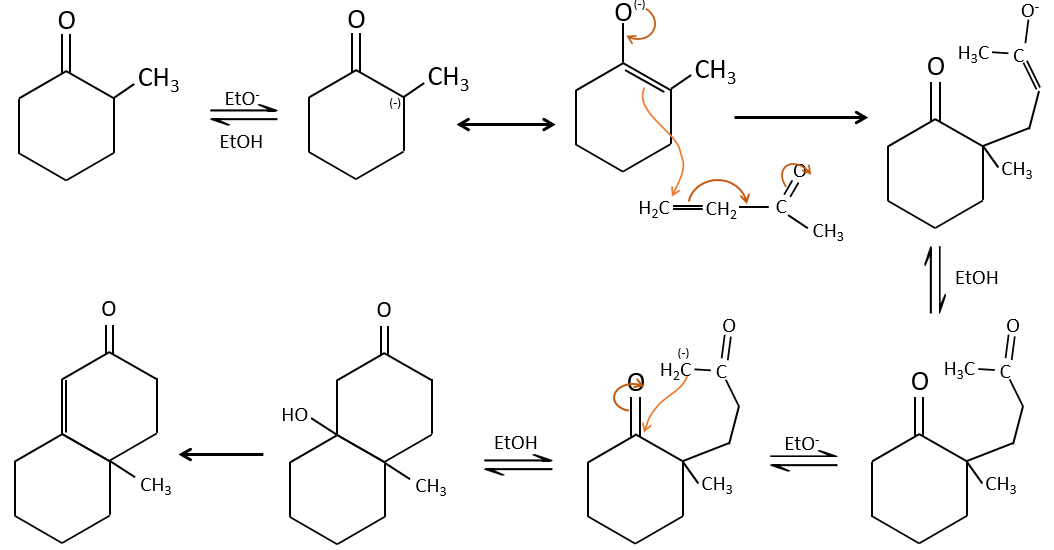
Mais les additions peuvent également être réalisées dans plusieurs cas sur les systèmes conjugués. Ce sont les additions 1,4.
L’addition de Michael peut être suivie d’une condensation aldolique intramoléculaire, la réaction est connue sous le nom d’annulation de Robinson.